
滤泡性淋巴瘤(FL)是最常见的惰性非霍奇金淋巴瘤,具有复杂的疾病生物学特性和显著的临床异质性。大多数FL患者的中位生存期超过18年,但仍有部分患者会迅速复发或对标准治疗难治。通过在诊断和治疗过程中对于高风险的临床因素和生物学特征的认识,可以识别出更多易感或预后不良的患者,这有助于减少不良预后的发生。与实体肿瘤不同,淋巴瘤(尤其是FL)患者的治疗大多数仍然是基于经验治疗,即基于抗CD20/化疗联合治疗。
那么,临床医生和学者如何利用不良预后因素的相关认知对FL患者进行个体化治疗呢?在大多数患者生存期较长的情况下,通过设计一种风险适应的治疗策略可以使患者获得临床获益。基于风险分层的个性化治疗可能有助于容易发生进展和早期死亡的患者。这也会避免对风险较大患者进行过度治疗,以及避免无意中对原本有利的预后造成影响。
2021年10月,Luminari等人于Journal of Clinical Oncology杂志报道了FOLL 12研究的长期结果,该研究探索了FL一线诱导后反应适应性维持治疗对比利妥昔单抗标准维持治疗对于进展期FL患者的疗效。这是基于FL结局相关风险因素(使用微小残留病[MRD]和影像学)修改治疗手段的重要尝试。但该研究未达到主要终点。2022年1月,Carla Casulo教授于Journal of Clinical Oncology杂志发表了一篇关于FOLL 12研究的社论文章,他表示虽然该研究未达到主要终点,但为未来使用个性化方法限制淋巴瘤进展打开了大门。
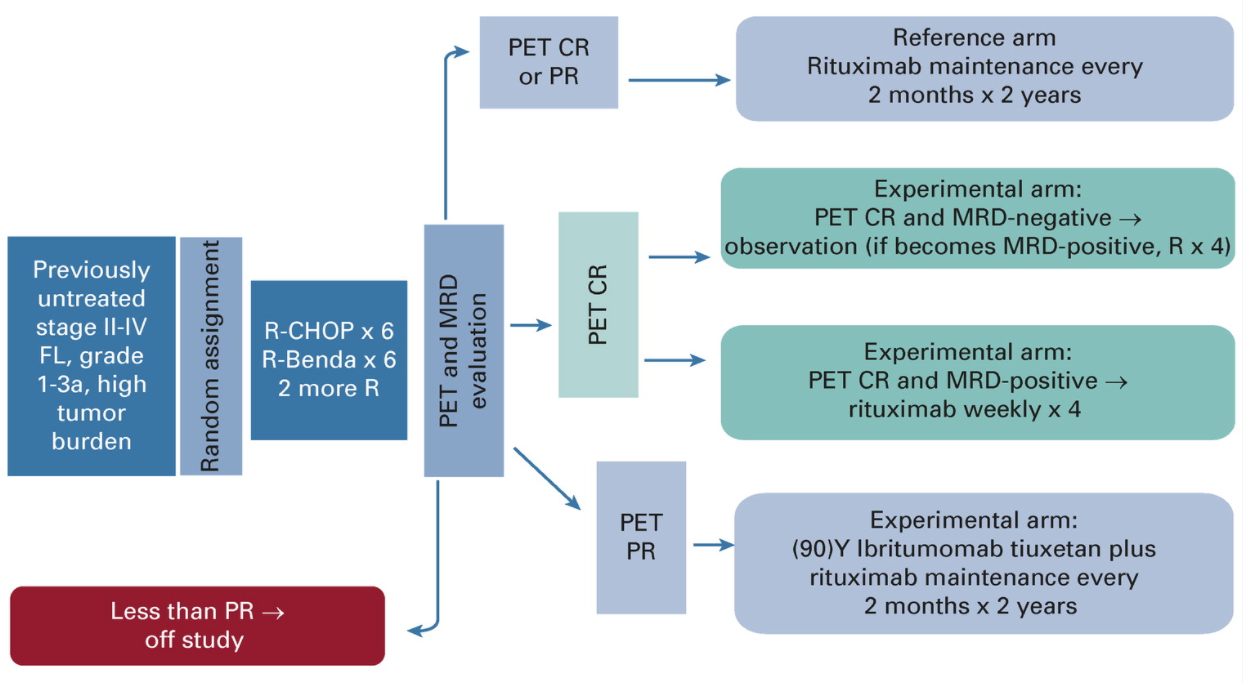
FOLL 12研究设计
FOLL 12研究是一项多中心的研究,包括了既往未经治疗的II期或更高级别的FL患者,这些患者的肿瘤负荷较高。共807名患者在治疗前被随机分组,接受6个周期的利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松或利妥昔单抗联合苯达莫司汀诱导治疗,随后再接受2个周期的利妥昔单抗治疗。患者按FLIPI评分1-2和3-5进行分层。研究者假设对预后的最大影响因素是通过加强对生存风险最高的患者的干预,生存风险最高定义为在分子评估和代谢成像(MRD)阳性和PET阳性(未达到完全代谢缓解[CMR])的基础上有持续疾病的证据。这一概念是建立在一线治疗结束时PET呈阳性是FL预后不良的标志,也是外周血或骨髓中残留疾病的证据的认识之上。同时,研究者尝试限制对预后良好患者的干预措施,特别是那些CMR和MRD均阴性的患者。
该研究设计了一个对照组,所有反应良好的患者(部分代谢缓解或CMR)无论MRD状态如何,在2年内每2个月接受标准利妥昔单抗维持治疗。试验组分为2个PET阴性组和1个PET阳性组:(1)观察PET阴性(CMR)和MRD阴性患者;(2)给予利妥昔单抗治疗PET阴性(CMR)和MRD阳性患者直到MRD阴性(最多4次剂量)。PET阳性(非CMR)患者每2个月接受90Y标记的CD20单抗Ibritumomab Tiuxetan和利妥昔单抗维持治疗,持续2年。最初的主要终点是评估与利妥昔单抗标准维持治疗相比,基于氟脱氧葡萄糖-PET和MRD缓解的维持治疗是否产生更长的PFS。然而,在发现CMR和分子水平缓解在两组中都很高后,研究者发现这是不太可能证实的假设。因此,本研究改为非劣效性设计,以评估PFS在对照组中与试验组相比是否较短。
总共有744名患者完成了诱导治疗并符合缓解条件。712名患者的总缓解率(ORR)为96%(95% CI, 94-97)。然而,中位随访53个月后,即使采用非劣效设计,并经过FLIPI2和诱导类型调整校正,试验组的进展风险仍高于对照组,对照组的3年PFS率为86%,试验组为72%(95% CI, 67-76)。
综上,需要对每个试验组的研究方法和结果进行深入评估与分析。为了评估MRD,Luminari等人采用实时定量聚合酶链反应(PCR)检测,采用标准化流程对外周血和骨髓中的IGH/BCL2基因重排进行靶向检测,即在FL中确定MRD的金标准。PCR的工作原理是利用引物检测肿瘤特异性DNA序列,并随后放大这些序列。许多研究已经证实了MRD评估在FL中评估患者预后的效用。然而,基于PCR的评估仅限于携带t(14;18)的患者。但只有约60%的患者具有可识别的分子标记,因此高达40%的FL患者不符合MRD评估的条件。
在FOLL 12研究中,712名患者中的300名(对诱导治疗有反应的患者中的42%)无可用的分子标记进行MRD检测,这可能对试验组产生影响。随着二代测序方法的出现,通过识别循环肿瘤细胞或脱落到血液/血浆中的DNA(循环肿瘤DNA),能够识别肿瘤组织或血液中的免疫球蛋白基因。此外,使用超灵敏的CAPP-SEQ(深度测序癌症个体化分析,cancer-personalized profiling by deep sequencing)方法可以检测体细胞基因改变。虽然目前研究主要集中在弥漫性大B细胞淋巴瘤和套细胞淋巴瘤,但该技术和其他新技术在FL中具有研究前景。
此外,PRIMA和GALLIUM III期研究证实了利妥昔单抗维持治疗作为FL诱导后巩固治疗的益处,这两项研究均证明其可延长患者的PFS。FOLL 12研究中的试验组根据患者MRD状态对该方法进行测试。在FOLL 12中,对照组中只有51例MRD阳性患者。其中,有32例(62%)患者在标准的利妥昔单抗维持治疗后转变为MRD阴性。相比之下,试验组中76名患者MRD阳性,其中46名患者接受了利妥昔单抗维持治疗,46例患者中有26例(57%)随后达到MRD阴性。此外,与对照组MRD阳性患者相比,利妥昔单抗维持治疗方法患者的3年PFS率低于MRD阳性患者(P<0.001)。另外,一部分MRD阴性的患者在诱导后又发生淋巴瘤进展和MRD复发。基于这些结果,Luminari等人提出,所有有反应的患者都应该接受利妥昔单抗维持治疗,因为对CMR PET阴性的患者的试验性干预无法预防疾病进展。
Carla Casulo教授表示,标准的利妥昔单抗维持治疗在有反应的FL患者中是最有希望降低淋巴瘤进展风险的方法。然而,哪些患者应接受维持治疗仍然是一个经常争论的问题,并且要根据患者的年龄、潜在毒性、共患病和对一线治疗的反应来权衡。例如,感染并发症(包括3-5级感染)在GALLIUM研究中已经有了研究结果,GALLIUM是一项随机研究,比较了奥妥珠单抗为基础的免疫疗法和利妥昔单抗为基础的免疫疗法。虽然在接受苯达莫司汀治疗的患者中发生严重感染的频率更高,但多数还是发生在治疗的维持阶段。FOLL 12研究中可能对维持治疗的安全性和不良事件的全谱报告不足,研究者同样提到的限制措施可能会减少这种方法产生的并发症。此外,FOLL 12和其他随机对照试验都没有证明其对FL患者的总生存期有益。考虑到长期治疗的成本和毒性,这一情况需要仔细衡量。
FOLL 12研究中,更令人关注的问题不是关于是否所有患者都应该接受维持治疗,而是应该如何完善一种策略,以确定哪些患者会从降级或强化治疗中受益。因此,FOLL 12研究中提出的不仅是推荐利妥昔单抗维持治疗。更重要的是表明一种适应反应的治疗方法在多中心环境下是可行的,并且确定了用不同的治疗方法治疗不同风险群体是可行的。
那么后续风险适应研究的目标是否应更广泛? Carla Casulo教授表示,针对患者的个性化治疗需要继续探究,FOLL 12研究是建立在未来临床试验设计上的一种有效模型。未来的研究应该测试二代测序方法,在大多数患者的诊断中收集敏感度更高的分子标记物,探索新的维持治疗策略,利用FL的生物学脆弱性,限制治疗时间长度和毒性,并加入患者报告的结果。FL的治疗确实处于改变的门槛,期待着将适应缓解状态的精准治疗作为一种不断发展的标准。