
2024年6月,大连医科大学附属第二医院血液科闫金松主任医师团队作为第一单位及通讯单位在Elsevier出版社旗下英文杂志Biomedicine & Pharmacotherapy在线发表了研究论文“Ciwujianoside E inhibits Burkitt lymphoma cell proliferation and invasion by blocking ENO1-plasminogen interaction and TGF-β1 activation ”。Biomedicine & Pharmacotherapy杂志是一本以医学/药学综合研究为特色的国际期刊,在JCR 分区中,该期刊为医学和药学领域Q1区期刊。该论文第一作者为辽宁省造血干细胞移植转化医学省重点实验室副研究员王海娜,博士研究生张珊珊为共同第一作者。同时,大连医科大学孙明忠教授团队、西交利物浦大学吴思晋教授团队及中国科学院大连化物所王超然研究团队参与了该项工作。

ENO1是一种多功能蛋白,主要位于细胞质中并存在于细胞表面。其在糖酵解中的酶功能涉及将2-磷酸-D-甘油酸转化为磷酸烯醇丙酮酸。此外,ENO1在细胞表面能够作为

图1. ENO1在BL中过表达,与不良临床预后相关
研究团队首先通过构建稳定敲低ENO1的细胞株,对细胞的增殖能力,侵袭能力,克隆形成能力,细胞周期及细胞凋亡等进行了检测,结果表明敲低ENO1后,细胞的增殖能力、克隆形成能力和侵袭能力均显著下降。为了进一步明确该现象,团队构建了小鼠肿瘤模型,在小鼠体内进行了研究。结果显示,敲低ENO1的肿瘤细胞在小鼠体内的增殖和侵袭能力均显著降低,具体表现为外周血,脾脏和骨髓中肿瘤细胞的比例在敲低ENO1的小鼠模型中显著降低。免疫组化也同样印证了该结果(图2)。

图2. ENO1在体内外均可促进伯基特淋巴瘤的增殖和侵袭
为了进一步阐明ENO1促进伯基特淋巴瘤增殖和侵袭的作用机制,团队借助全转录组数据分析,联合细胞生物学,分子生物学,及小鼠模型实验,证实ENO1表达升高后,能够在细胞膜表面招募更多的纤溶酶原蛋白(PLG,plaminogen),从而生成大量能够降解细胞外基质的活性蛋白纤溶酶(PL,plasmin),PL进一步激活TGF-β1信号通路和PI3K-AKT信号通路,最终促进细胞发生上皮间质转化(EMT,epithelial-mesenchymal transition)。该研究结果阐明了BL高侵袭性背后的分子机制(图3)。

图3. ENO1通过活化纤溶酶原进而激活TGF-β1信号通路发挥功能
为了寻找有效的ENO1-PLG相互作用抑制剂,研究团队采用了虚拟筛选技术,针对含有约25,000种天然产物的化合物库进行筛选,获得五种候选化合物。在进一步的分子动力学(MD)模拟中,刺五加皂苷E(L-06)能够与ENO1-PLG的潜在相互作用界面——ENO1的两个单体间——发生稳定的相互作用。为了验证L-06的结合位点,通过突变实验分析确定R31、E376和D377是关键
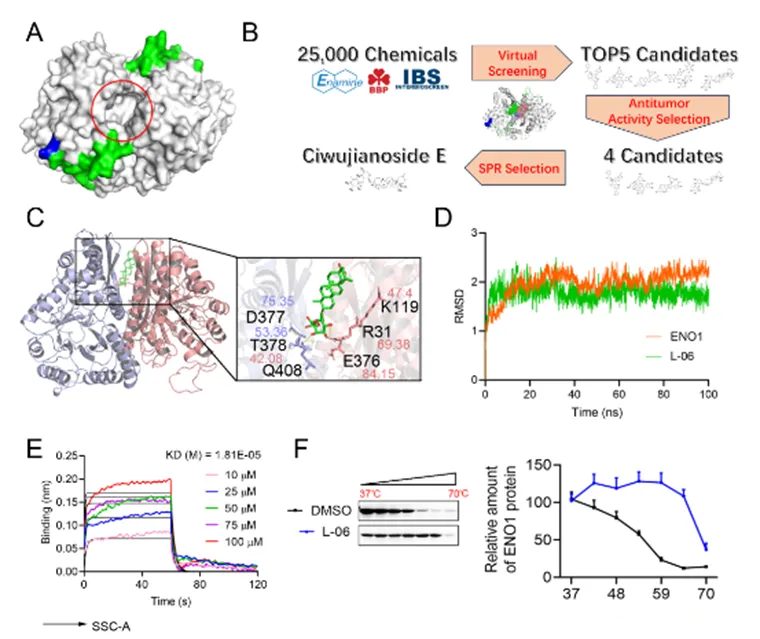
图4. 药物筛选流程及靶标实验验证
通过细胞实验,物理化学实验等,团队证实L-06能够有效破坏ENO1与PLG之间的相互作用,从而减少PL的生成并抑制TGF-β1的活化,进而显著抑制了BL细胞的增殖和侵袭。小鼠体内实验结果初步证实了L-06能有效抑制BL在体内的增殖和侵袭(图5)。

图5. L-06有效抑制BL在体内的增殖和侵袭
该研究从临床问题初发,采用细胞生物学,小鼠肿瘤模型等基础生物学研究手段阐明了ENO1分子的作用机制,又进一步结合虚拟筛选和计算生物学方法获得了靶向ENO1的小分子抑制剂,为BL的治疗提供了全新的策略。尽管该研究仍处于早期阶段,但其结果表明L-06有望成为一种有效的BL靶向治疗药物。研究团队计划在未来开展相关的转化研究,以评估L-06的安全性和有效性,为BL患者带来新的治疗选择。图6为该论文的图形摘要。
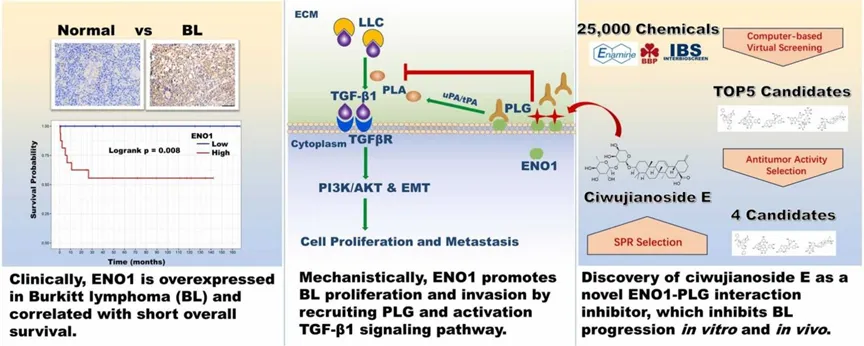
图6. 文章研究流程