
异基因造血干细胞移植(Allo-HSCT)是治疗大多数急性白血病亚型及髓系肿瘤的标准方法,通常能够实现治愈。然而,造血干细胞移植(HSCT)后疾病复发率超过30%,复发后的预后较差,2年总生存率低于20%。HMHA-1(ARHGAP45)基因编码一种造血系统特异的次要H抗原,具体来说是一种多态性肽(VLHDDLLEA,“HA-1+”,基因型RS_1801284 A/G或A/A),由常见的HLA-A*02:01分子呈现。移植后,HA-1阴性(VLRDDLLEA,“HA-1-”,基因型RS_1801284 G/G)的供体T细胞可以被激活或通过遗传修饰来表达针对HA-1的特异性T细胞受体,从而发挥抗白血病效应。
美国研究者报告了首次在人类中的I期试验(NCT03326921)结果。医脉通整理如下,并特邀中山大学附属第三医院刘加军教授进行点评,以飨读者。
研究方法
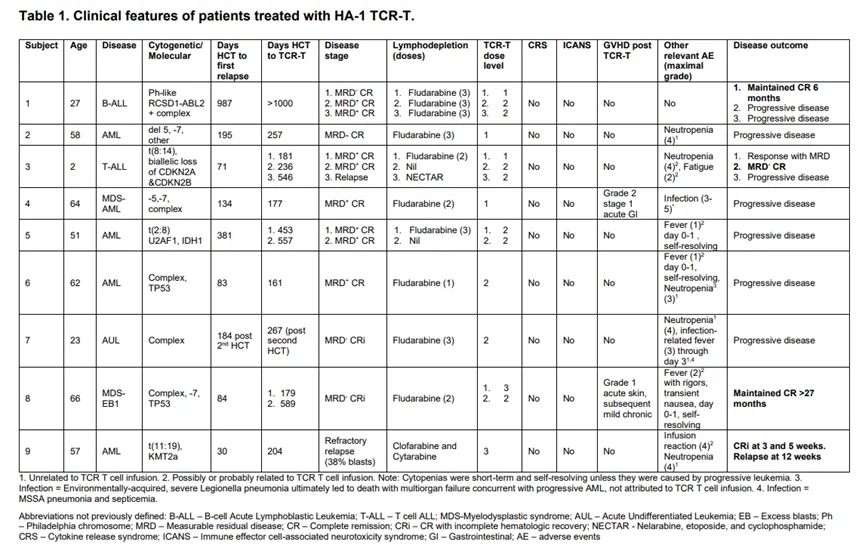
该试验涉及9例HLA-A*02:01+ HA1+患者,他们在接受HA-1-供者的造血干细胞移植后复发了白血病。白血病患者接受HSCT前后,或是移植后复发时,会为患者和造血干细胞捐赠者进行HA-1多态性的基因分型。将适合的不匹配患者邀请入组(患者:HLA-A*02:01+ RS_1801284 A/G或A/A;供体:HLA-A*02:01⁻或RS_1801284 G/G)。试验采用了3×3剂量递增设计,起始剂量为3 × 106 TCR-T/kg,递增至30 × 106 TCR-T/kg(图1)。患者接受淋巴细胞清除化疗,随后行≥1次HA-1 TCR-T的输注治疗(表1)。
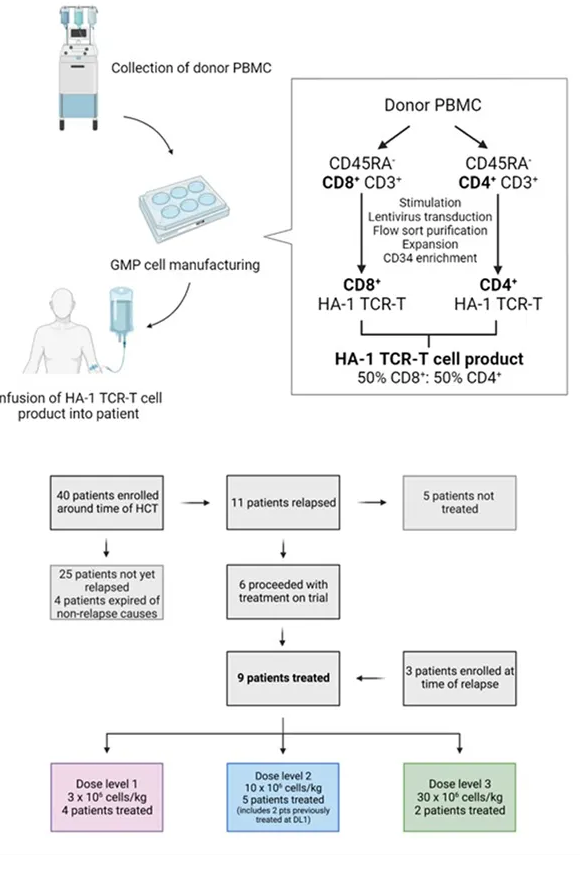
图1
表1
主要终点是HA-1 TCR CD8+ TM和CD4+ TM的制造和给药的可行性,以及HA-1 TCR-T的剂量限制性毒性。次要终点包括转移的CD8+和CD4+HA-1 TCR-T在周围血液中的体内持久性,以及骨髓中HA-1 TCR-T的存在、比例和持久性。
研究结果
01接受治疗的患者
9例在接受造血干细胞移植后复发的髓系恶性肿瘤(n=7)或ALL(n=2)患者接受了HA-1 TCR-T治疗,先用单药
02产品制造及输注评估
在生产开始时,通过去除CD45RA+细胞,降低了与供体非成熟T细胞相关的移植物抗宿主病(GVHD)风险,并使产品更倾向于中央记忆T细胞(TCM)表型,以增强其在体内的持久性。在转导、富集和扩增HCT供体TM之前,T细胞被主要分为CD4+和CD8+组分,以便控制细胞产品中的CD4:CD8比例(目标为1:1)(图1)。9例患者均成功达到了计划的剂量水平。
03HA-1 TCR-T的持续性和扩展性
HA-1 TCR-T在输注后通过MFC对患者的血液和骨髓进行定量检测。结果显示,所有患者的血液和骨髓样本中均可检测到TCR-T(图2)。在14次总输注中,有10次观察到血液中TCR-T的峰值扩张,发生在输注后4至11天,浓度范围从0.7 CD3+ TCR-T/μL(患者4,剂量水平1 [DL1])至31 CD3+ TCR-T/μL(患者9,DL3)。CD4+ TCR-T的扩展始终显著高于CD8+ TCR-T(P=0.0373)。
在9例患者中,有8例几乎在所有时间点都能检测到TCR-T,并且这种扩增持续超过12个月。其中,患者9的TCR-T扩增最为显著,该患者的
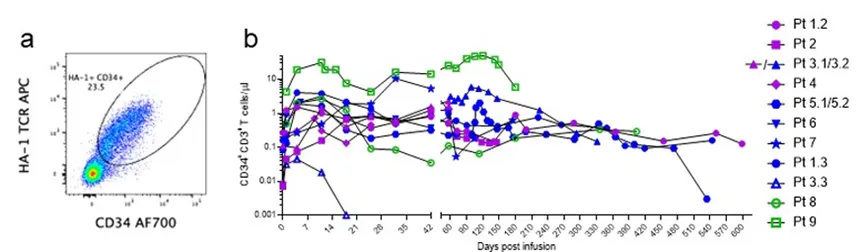
图2
04治疗结果
所有患者均良好耐受输注,未出现细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)或剂量限制性毒性。输注后,最常见的不良事件是短暂且可自我消退的
值得关注的是,HA-1 TCR-T的过继转移显示出安全性,并表现出有希望的抗白血病活性,尽管大多数患者接受的细胞剂量相对较低。
研究结论
该试验标志着对Allo-HSCT后复发患者急需新疗法的重大进展。研究成功达成主要终点,验证了治疗的可行性和患者安全性。通过使用CD8+和CD4+ TCR-T,首次在临床层面证明CD4+ T细胞可以通过引入CD8共受体成功重新定向,以针对HLA I类呈递抗原。结果显示,HA-1可作为治疗HCT后白血病复发的靶点。尽管大多数患者接受了相对较低剂量的TCR-T,但在9例患者中,有4例出现了疗效信号,其中1例在治疗后超过27个月仍维持缓解状态。此外,针对HA-1的其他次要H抗原的TCR-T疗法也展现出良好前景,值得进一步临床开发。
专家点评:
该研究在TCR-T疗法领域展现了多项重要创新。在当前Allo-HSCT后复发率超过30%、复发后2年生存率不到20%的背景下,开发新型细胞治疗策略尤为重要。现有的TCR-T和CAR-T细胞在治疗HCT后复发的AML方面效果不佳,而本研究首次在临床上成功实现了CD4+ T细胞通过CD8共受体重定向识别HLA I类呈递的抗原,且CD4+ TCR-T的扩增和持久性优于CD8+ TCR-T,为增强TCR-T疗法提供了新的细胞工程策略。通过靶向次要组织相容性抗原HA-1,实现了对白血病细胞的特异性识别,同时避免了对正常组织的攻击,显著降低了GVHD风险,这是免疫治疗领域的重要突破。特别是HA-1作为造血系统特异性抗原,可以特异性识别recipient来源的白血病细胞而不攻击donor来源的正常造血细胞,这种特异性使其既可用于治疗复发也可用于预防复发。研究创新性地采用了清除CD45RA+细胞、控制CD4:CD8比例等产品制备策略,这些优化措施有助于增强T细胞的体内持久性和功能性。更重要的是,研究首次通过单细胞RNA测序深入研究了治疗耐药机制,为理解白血病如何逃避TCR-T治疗提供了新的见解,这对开发新的治疗策略具有重要指导意义。
然而,该研究仍存在一些限制。首要的局限是当前设计的TCR产品适用人群受限,仅适用于HLA-A*02:01+且具有特定受者/供者基因型配对的患者(占HSCT人群的10-15%)。不过这一局限可通过开发针对其他HLA限制性的HA-1特异性TCR来克服。其次,现有治疗方案的效果仍有显著提升空间,9例患者中仅4例显示出疗效,且除1例外均出现疾病进展或复发,提示需要在未来从多个方向进一步优化策略,包括细胞产品制备的优化,如改进CD4+/CD8+ T细胞共培养方案、优化CD45RA+细胞清除策略等,其次是给药方案的优化,如文中大部分剂量较低是否可以提高治疗剂量、设计多次给药方案、探索疫苗加强策略、优化淋巴细胞清除预处理方案等。由于是I期研究样本量小无法系统评估疗效,需要未来进一步验证疗效。另外研究通过单细胞RNA测序系统地揭示了包括TGFB1、RIPK2、LDHA等在内的多个潜在免疫逃逸机制,但对这些机制的功能验证以及如何据此改进治疗策略还需要进一步研究。
就更广泛的发展前景而言,TCR-T疗法正在迅速发展,包括WT1、NY-ESO-1等多个靶点的临床试验正在进行,显示出治疗多种类型癌症的潜力。HA-1作为造血系统特异性抗原具有独特优势,这种具有个性化特征的免疫治疗策略原则上可用于各类血液系统恶性肿瘤的治疗。通过开发针对不同HLA限制性的TCR,这一策略有望覆盖更广泛的患者人群。未来可以进一步考虑建立更完善的监测和评估体系,包括TCR-T细胞功能监测、免疫逃逸机制评估和生物标志物开发;也可以考虑探索联合治疗策略,针对已发现的免疫逃逸机制(如TGFB1、RIPK2、LDHA)设计相应的联合治疗方案。该研究的成功为开发针对其他次要组织相容性抗原的TCR-T疗法提供了重要参考,通过这些优化策略的实施,有望进一步提高治疗效果,为血液系统恶性肿瘤患者提供更多更好的治疗选择。