
CAR-T细胞疗法已成为一种有前景的过继性T细胞疗法,用于治疗特定的血液系统恶性肿瘤,包括白血病、淋巴瘤和多发性骨髓瘤(MM)。目前,中国已经成为CAR-T细胞临床试验注册数量最多的国家。尽管CAR-T细胞疗法取得了可观的临床疗效,但疾病复发、CAR-T细胞制备工艺以及安全性等问题仍然限制了CAR-T细胞疗法在血液系统恶性肿瘤中的应用。黄晓军教授、黄河教授、梁爱斌教授、孙葳医生就CAR-T细胞疗法在中国的发展现状、挑战以及未来趋势进行了总结,并对我国优化CAR-T细胞疗效和安全性的策略进行了介绍。想知道CAR-T细胞疗法在中国的现状以及未来发展趋势如何?一起往下看看吧!
中国开展CAR-T细胞疗法临床试验的概况及特点
截至2022年12月,ClinicalTrials.gov上报告和/或注册了458项来自中国的试验,其中大部分试验针对血液系统恶性肿瘤领域(73%,n=337),其次为实体瘤领域(24%,n=111),且在所有肿瘤类型中,中国的注册试验数量均超过美国(图1A)。从临床试验阶段的分布来看,中国和美国趋势相当,I期临床试验占比最高,III期临床试验占比最低。从临床研究的样本量(血液系统恶性肿瘤领域)来看,中国的临床试验样本量多在10-30例之间,仅有少数研究纳入了约100例患者,相比之下,美国的临床试验样本量>30例患者的比例较高(图1C、D)。
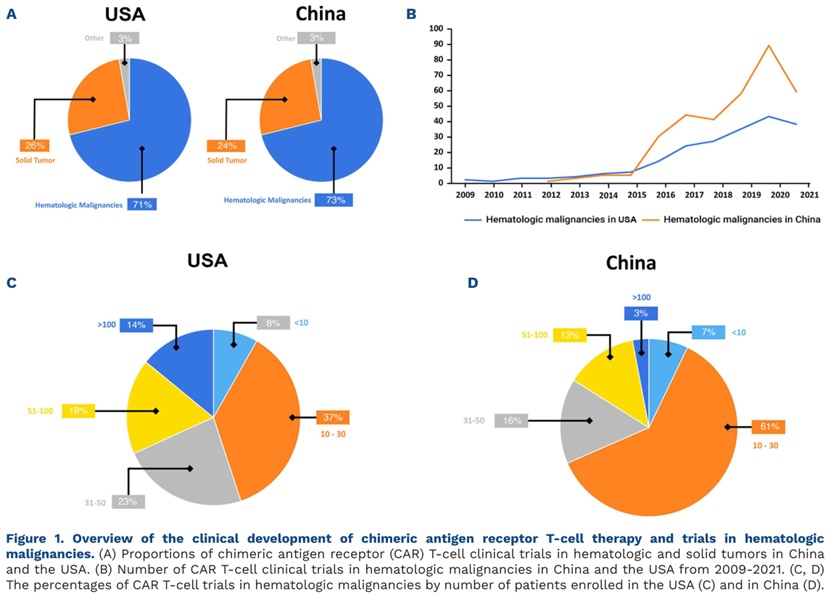
图1
CD19和BCMA是中国临床试验中最常见的靶向抗原,在血液系统恶性肿瘤领域分别有127项和36项临床试验,在美国也观察到类似的趋势(图2A、B)。相比之下,中国针对多靶点(≥2个)的临床试验比例较高,其中CD19+CD22占25项,CD19+CD20占17项,美国针对多靶点的临床试验也最常涉及CD19+CD20以及CD19+CD22(图2C、D)。此外,中国研究者对于靶向BCMA+其他靶点的CAR-T细胞治疗的探索更为深入。
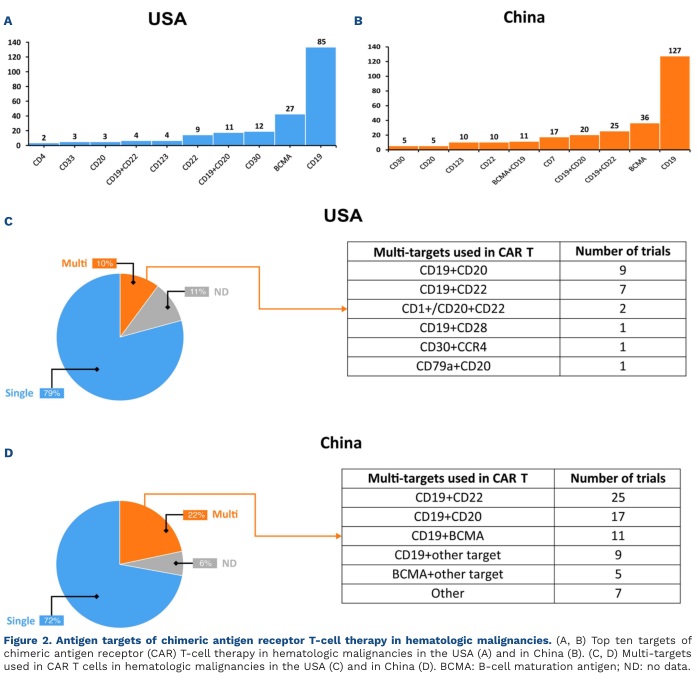
图2
在CAR-T细胞疗法联合治疗方面,中国与美国的探索大多相似,除相同的治疗方案外,主要的差别在于:在白血病/淋巴瘤方面,中国探索了西达本胺/地西他滨(2项试验)和达沙替尼(1项试验),而美国探索了PI3Kδ/γ抑制剂(1项试验)和双特异性抗体(1项试验);在MM方面,中国探索了西达本胺/地西他滨(1项试验)和达沙替尼(1项试验),而美国则对免疫调节药物、γ-分泌酶抑制剂以及抗体药物偶联物进行了探索(图3A-D)。
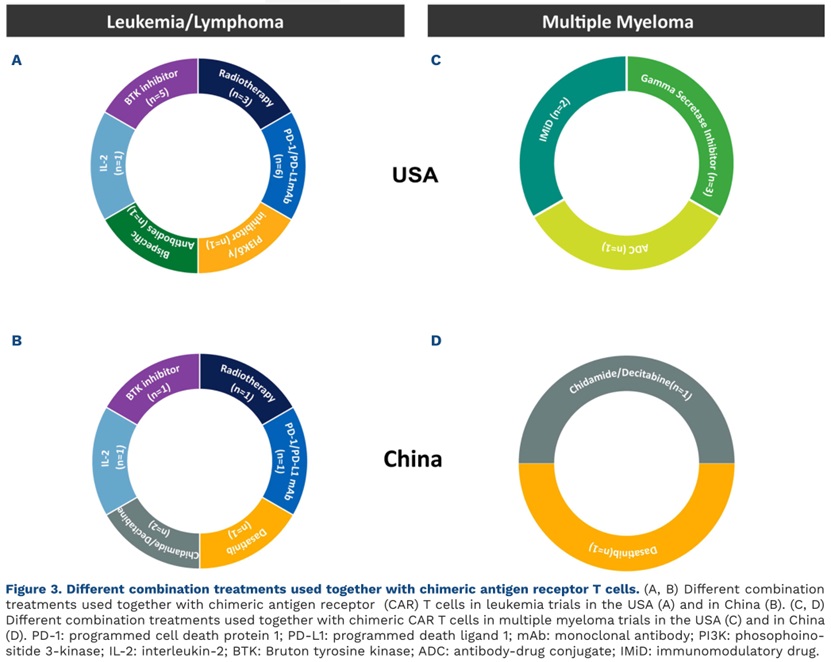
图3
提高CAR-T治疗疗效的中国经验
在中国,尽管CAR-T细胞疗法已在白血病、淋巴瘤和MM领域显示出可观的疗效,但仍有约30%-60%的患者在CAR-T治疗后复发。此外,难以识别理想的靶肿瘤抗原、抑制和耐药、抗原逃逸、CAR-T细胞的持久性和扩增能力下降、CAR-T细胞易受免疫抑制微环境的影响、挽救治疗期间疗效有限以及危及生命的毒性等问题仍然存在,给患者带来了巨大挑战。目前,针对上述问题的应对策略包括:探索复发后可供替代的靶点、多靶点组合、优化CAR-T细胞的结构、与其他药物联合治疗、通用型CAR-T等(图4B)。下文介绍了中国在提高CAR-T治疗疗效和安全性方面的应对策略(表1-6)。
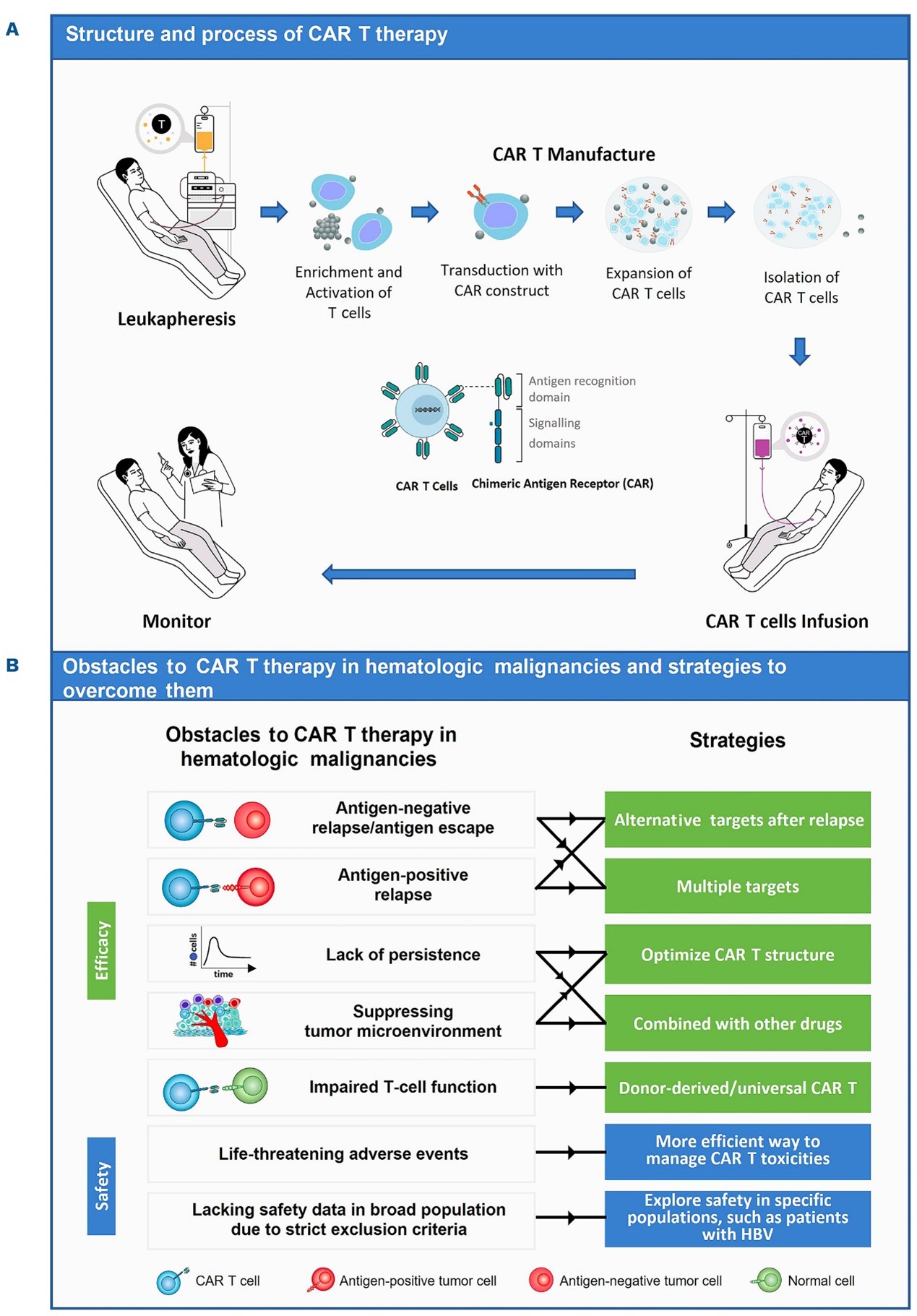
图4
白血病
目前白血病领域提高CAR-T治疗疗效的策略如表1所示,提高安全性的策略如表2所示。
表1
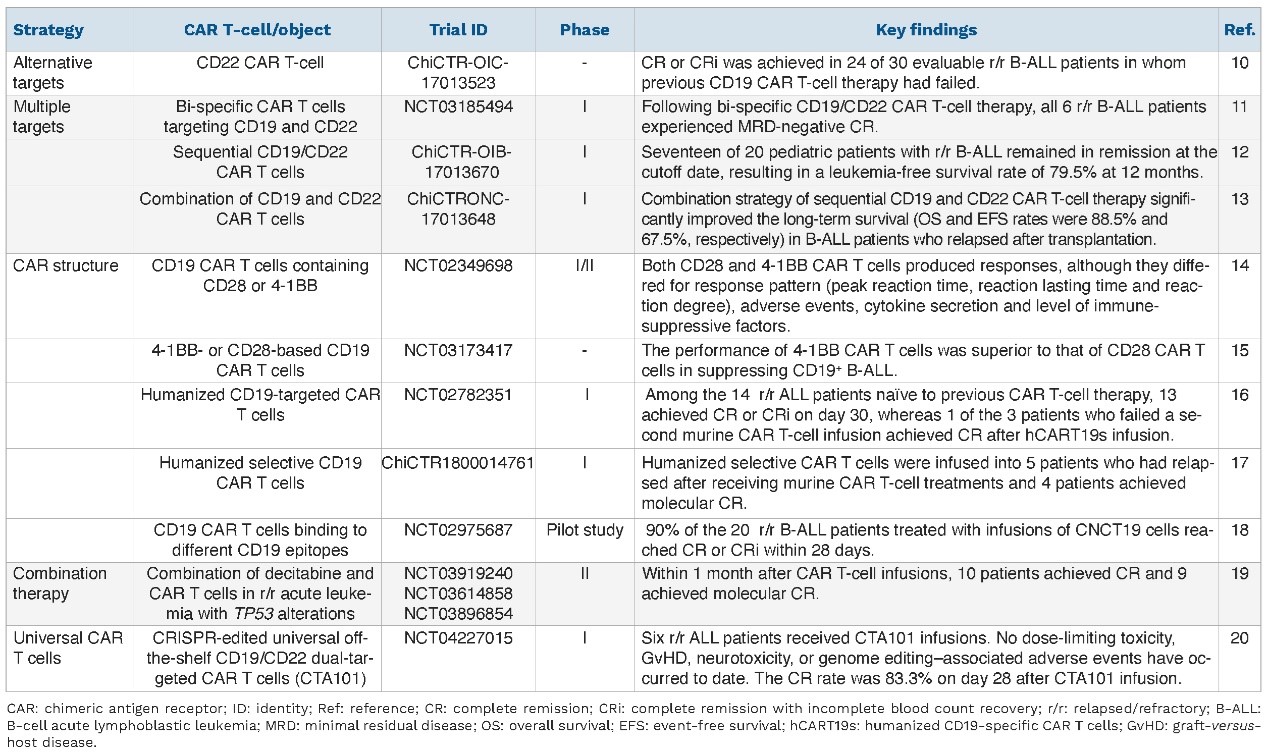
表2
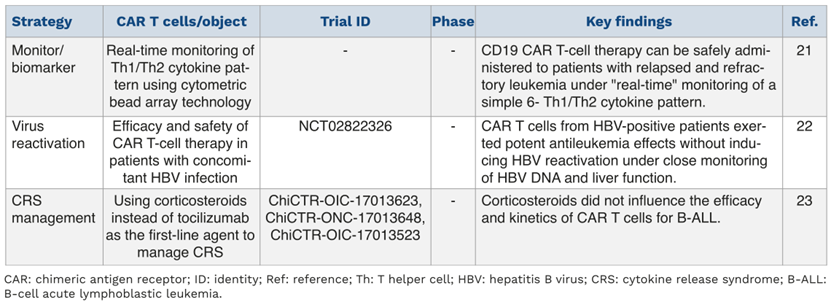
急性淋巴细胞白血病(ALL)
ALL是一种起源于B系或T系淋巴祖细胞的血液系统恶性肿瘤。儿童B-ALL的复发率为15%-20%,成人B-ALL的复发率为50%。耐药和复发是阻碍CAR-T细胞疗效的棘手问题,因此需要考虑提高CAR-T细胞疗效以及复发后重复治疗的策略。毒性和安全性也是阻碍ALL患者从CAR-T细胞治疗中获益的原因。
自体CAR-T细胞疗法易因数量有限和质量差而失败,因此,同种异体CAR-T细胞疗法成为一种有吸引力的替代疗法。然而,同种异体CAR-T细胞疗法面临移植物抗宿主病(GVHD)和移植物排斥反应的问题,目前已有多项研究表明,复发/难治性(R/R)ALL患者在异基因造血干细胞移植(allo-HSCT)前或后接受靶向CD19同种异体CAR-T细胞治疗,可避免或尽量减少与GVHD和移植物排斥反应相关的同种异体CAR-T细胞扩增失败。
目前,CAR-T细胞治疗的相关研究主要集中在B-ALL领域,而T-ALL领域的研究则相对较少。CD7在T-ALL/T淋巴母细胞淋巴瘤细胞表面高表达,多项研究表明,靶向CD7 CAR-T细胞疗法是T-ALL的一种安全且高效的治疗方法,未来仍需更多的患者以及更长时间的随访来进行验证。
10%-30%的B-ALL患者CAR-T治疗后复发是由于抗原逃逸(抗原阴性复发),而另一个常见的原因则是CAR-T细胞丢失,导致抗原阳性复发。针对抗原阳性复发:多项研究确定了含有CD28或4-1BB共刺激信号的靶向CD19 CAR-T细胞在ALL中的治疗潜力,结果提示基于4-1BB的CAR-T细胞比基于CD28的CAR-T细胞具有更高的疗效(由于持久性更强);此外,具有可结合不同CD19表位的scFv的CD19 CAR-T细胞可能为CD19阳性复发患者提供一种替代方案。针对抗原阴性复发,最近的研究提示,替代靶点(CD22、CD38)/多靶点组合可能使抗原阴性复发的ALL患者获益。鉴于CAR-T细胞治疗期间可能发生严重不良事件,因此不良事件的管理也尤为重要。
急性髓系白血病(AML)
AML患者接受标准化疗后的预后和生存结局较差,<60岁和>60岁患者的5年生存率约为40%-55%和10%-15%。在AML中,探索CAR-T细胞治疗的合适靶点至关重要,CD33在大多数AML患者中高表达,已成为治疗AML的潜在靶点,除此之外,CD38、CLL1和CD123也成为AML治疗的潜在靶点。
淋巴瘤
目前淋巴瘤领域提高CAR-T治疗疗效的策略如表3所示,提高安全性的策略如表4所示。
表3

表4
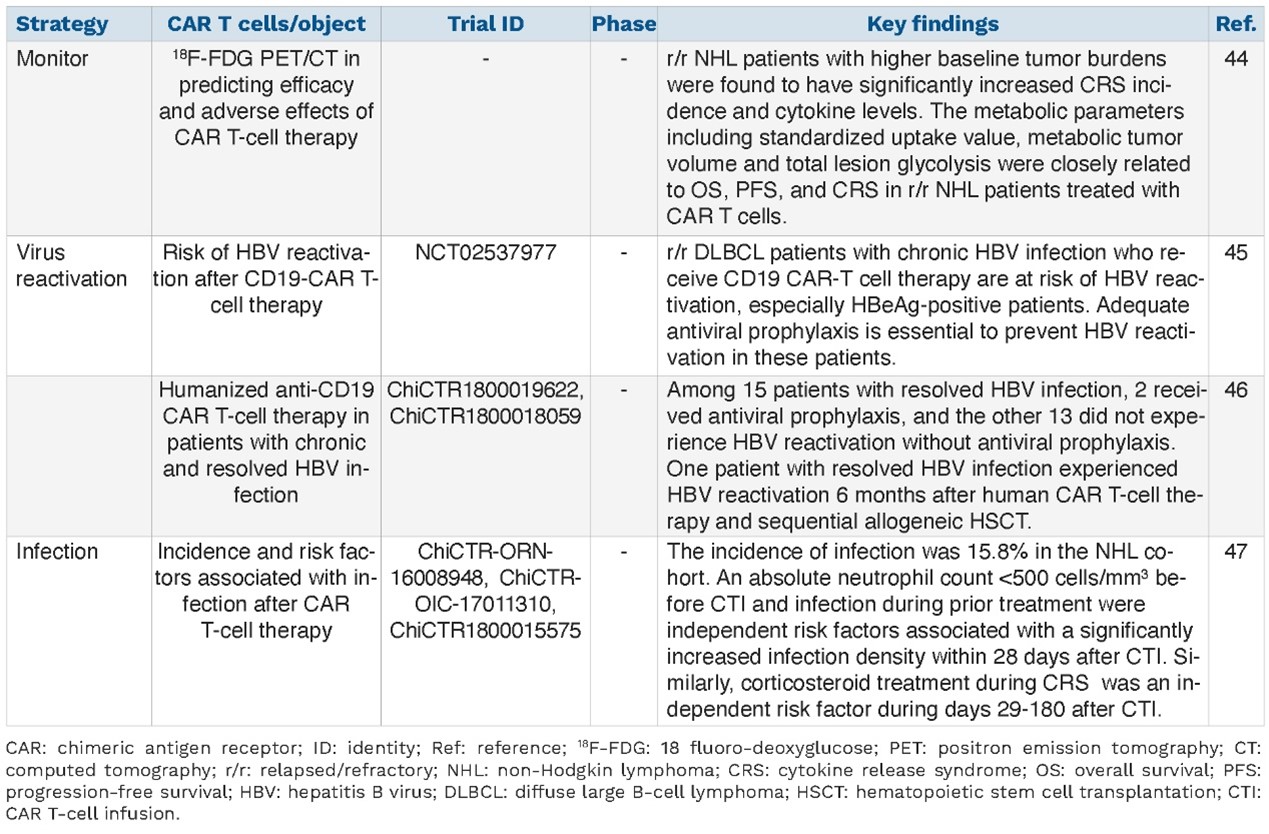
目前在非霍奇金淋巴瘤(NHL)领域探索的靶点包括B7-H3、Igβ、CD79b、CD30、BAFF、CTLA4、CD20和CD70,相关的临床前和临床研究正在进行中。
多靶点CAR-T细胞疗法是克服肿瘤细胞免疫逃逸的最佳策略,目前大部分研究采用CD19与其他靶点结合构建多靶点CAR-T细胞。
对于靶向CD19 CAR-T细胞治疗后复发的机制目前尚不明确,提高疗效的一种可能方法是与其他方案联合治疗,除传统治疗外,联合靶向治疗(BTK抑制剂/PD-1抑制剂)和免疫治疗也是联合治疗的热点方向,另一种策略是优化CAR-T细胞本身的结构。此外,虽然自体造血干细胞移植(ASCT)是R/R淋巴瘤的标准治疗,但有研究表明,CAR-T细胞治疗后患者的临床结局优于ASCT,因此未来可能会对CAR-T细胞治疗联合ASCT进行探索。
尽管有上述选择,但一些问题仍然限制了自体CAR-T细胞治疗的临床应用,因此,研究者对同种异体通用CAR-T细胞治疗在R/R淋巴瘤中的应用进行了探索。此外,在淋巴瘤中,对于不良事件的发生和严重程度的预测也尤为重要。
MM
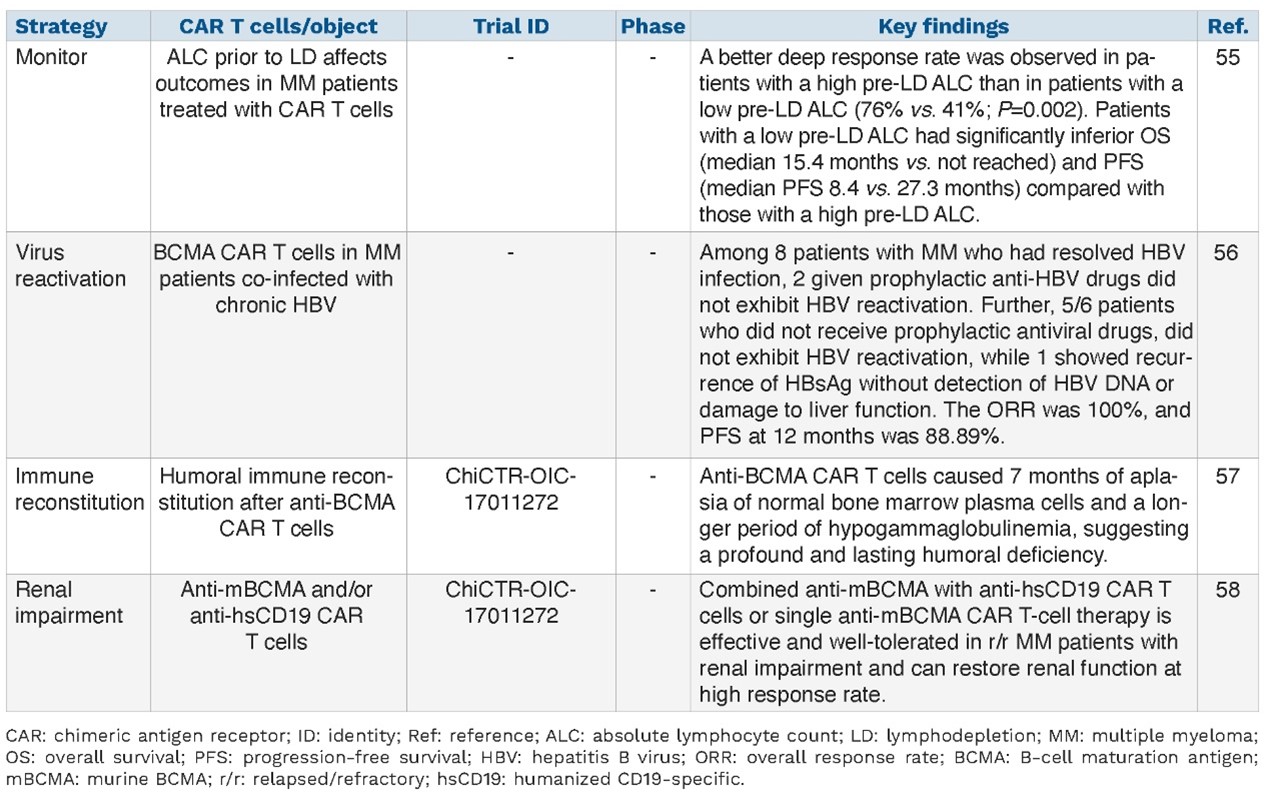
目前MM领域提高CAR-T治疗疗效的策略如表5所示,提高安全性的策略如表6所示。
表5
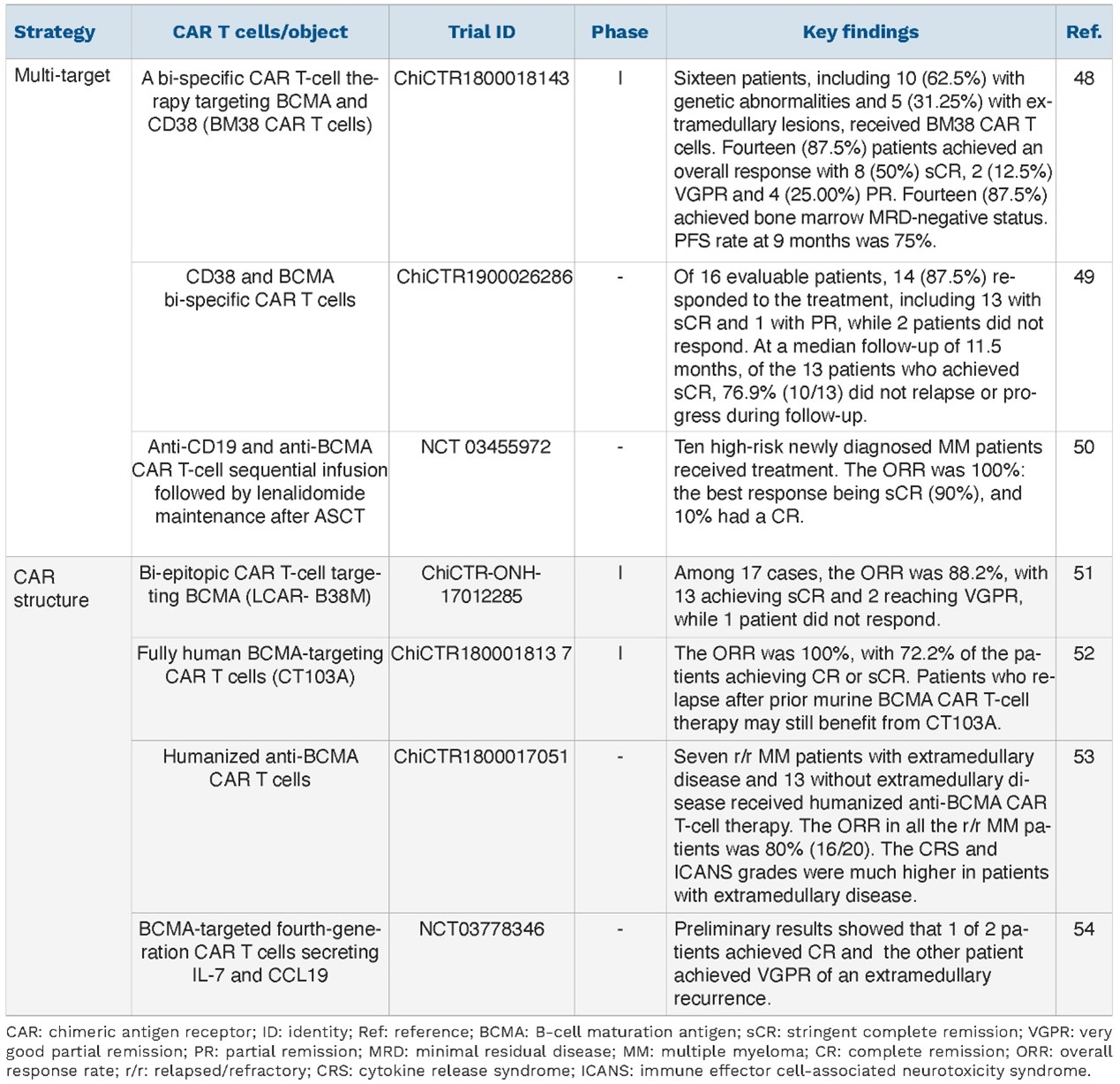
表6
靶向BCMA CAR-T细胞疗法在MM中获得了巨大成功,目前已有两款产品获得FDA批准用于治疗既往接受过≥4线治疗的MM患者。不同BCMA CAR-T细胞疗法的疗效不同,除研究设计和患者特征的差异外,不同BCMA CAR-T细胞的固有特征也可能影响其疗效,因此,近年来研究者在BCMA CAR-T细胞的修饰和优化方面进行了诸多探索。
靶向BCMA CAR-T细胞的疗效已得到验证,因此研究者对不同靶点组合的CAR-T细胞疗法在MM中的应用也进行了探索,最常见的靶点组合之一是靶向BCMA和CD19。此外,与BCMA联合的其他靶点还包括CD38和CS1,这两种靶点均已在MM中进行过研究,但这些新型双靶向CAR-T细胞疗法大多处于临床前开发阶段。
CAR-T细胞疗法的挑战和未来方向
在中国,CAR-T细胞疗法有望开启一个新的治疗时代,但CAR-T细胞治疗是一个复杂的过程,面临的问题贯穿治疗的各个环节,包括患者招募和入组、CAR-T细胞的制备过程、运送、白细胞单采和输注之间的间隔期以及巨大的成本等。尽管患者的总缓解率(ORR)较高,但复发和耐药一直是限制CAR-T疗法临床应用的障碍,另一个有待解决的问题是CRS和免疫效应细胞相关神经毒性综合征(ICANS)的管理,这两种疾病是CAR-T治疗相关的最常见毒性。
目前中国关于不同CAR-T细胞产品的靶点和疗效差异的共识和指南仍然缺乏。此外,迄今为止进行的临床试验中,对CAR-T细胞的细胞效力和药效学特征的探索仍不足,因此,需要在各医院/临床研究中心进行统一的系统管理和操作指导,以推进CAR-T细胞疗法的应用。
总结
随着靶向CD19和靶向BCMA CAR-T细胞疗法的不断突破,CAR-T细胞疗法为改善血液系统恶性肿瘤患者的预后和生活质量提供了另一条途径。相比之下,CAR-T细胞疗法对实体瘤的影响较小。诚然,一些不可忽视的问题(如高成本、耗时的制备过程、制备失败的固有风险、免疫相关不良事件、复发/难治以及无法浸润实体肿瘤组织等)仍有待解决。未来,我国仍需努力开发出成本和安全性可接受的CAR-T产品以惠及更多患者。