
【通用名称】 甲磺酸氟马替尼片
【商品名称】 豪森昕福
【英文名称】 Flumatinib Mesylate Tablets
【汉语拼音】 Jia Huang Suan Fu Ma Ti Ni Pian
成份:
本品主要成份为甲磺酸氟马替尼。
化学名称:N-[6-甲基-5-[[4-(吡啶-3-基)嘧啶-2-基]氨基]吡啶-3-基]-4-[(4-甲基哌嗪-1-基)甲基]-3-(三氟甲基)苯甲酰胺甲磺酸盐
化学结构式:
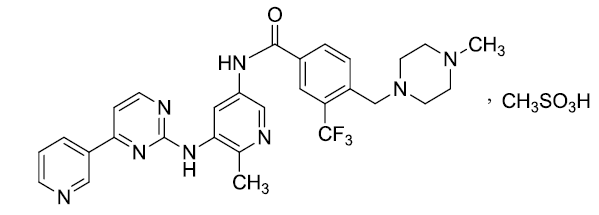
分子式:C29H29F3N8O·CH4O3S
分子量:658.69
所属类别:
化药及生物制品 >> 治疗肿瘤的药物 >> 小分子靶向治疗药物
化药及生物制品 >> 治疗慢性髓性白血病的药物
化药及生物制品 >> 治疗慢性髓性白血病的药物
作用类别:
Bcr-abl 酪氨酸激酶抑制剂
适应症:
本品用于治疗费城染色体阳性的慢性髓性白血病(Ph+ CML)慢性期成人患者。
规格:
(1)0.1g ;(2)0.2g(以甲磺酸氟马替尼计)
用法用量:
本品应当在对慢性髓性白血病(CML)患者有治疗经验的医师指导下使用。
本品为口服给药,推荐剂量为600mg,每天1次(qd),直至疾病进展或出现不可耐受的不良反应。
应空腹给药(服药前2小时和服药后1小时期间不要饮食),建议每天大致同一时间服用药物,吞咽完整药片,并用一整杯水送服,不要咀嚼或压碎。
只要患者受益,本品治疗应持续进行。
发生不良反应时的剂量调整
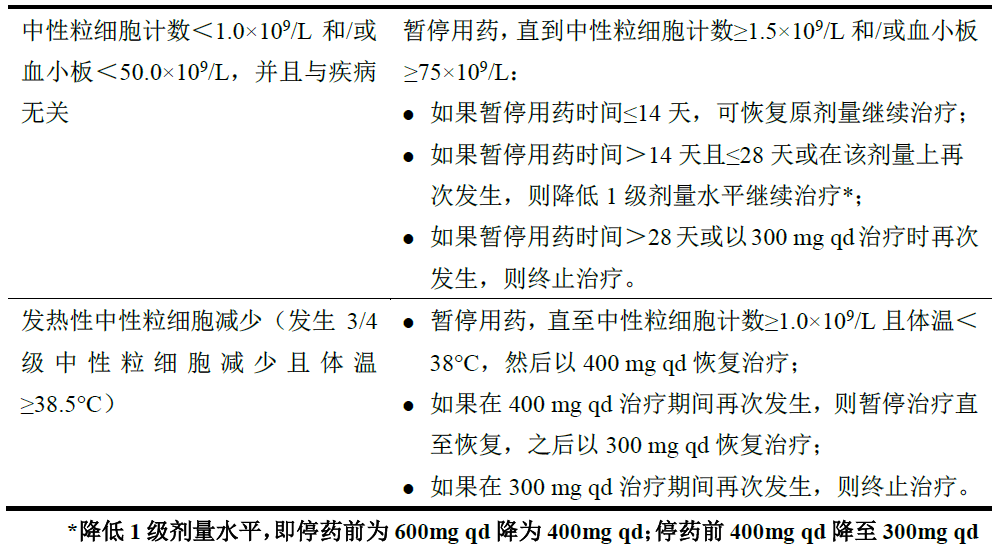
骨髓抑制:
在本品使用过程中,可以通过中断给药、降低剂量或终止治疗等方式处理骨髓抑制,必要时给予输注血小板和红细胞。发生中性粒细胞减少或血小板减少时的剂量调整见表1。
表1血液学毒性导致的停药和/或药物减量
非血液学不良反应:
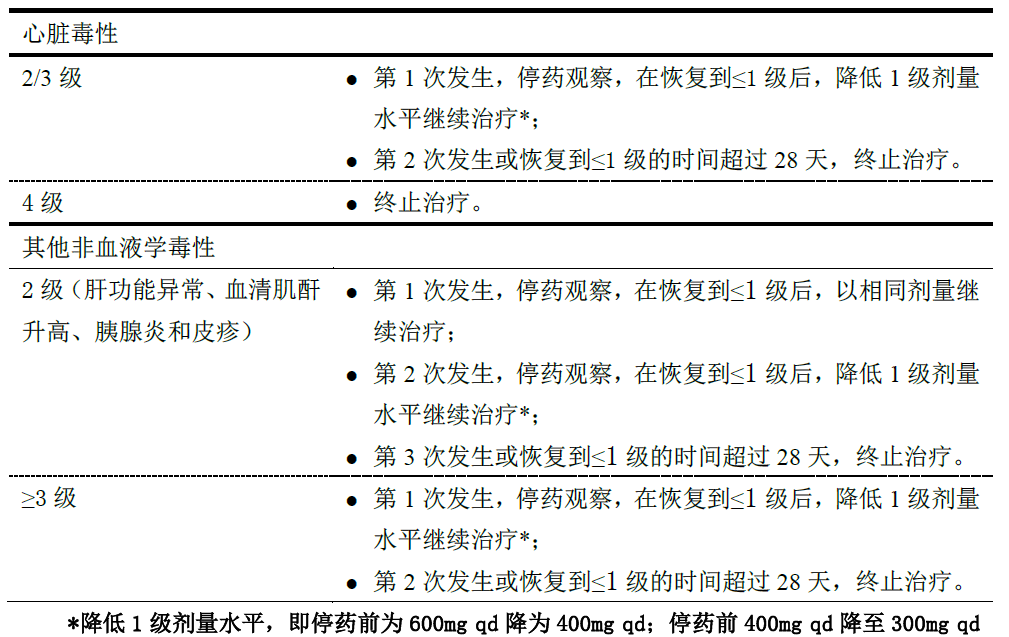
如果在本品用药过程中发生了3级及以上或部分特定的2级不良反应,应暂停治疗,直至不良反应恢复正常后可继续原剂量或降低剂量治疗。具体见表2。
表2非血液学毒性导致的停药和/或药物减量
不良反应:
本说明书描述了在临床试验中观察到的判断为可能由甲磺酸氟马替尼引起的不良反应及其近似的发生率。由于临床试验是在各种不同条件下进行的,在一个临床试验中观察到的不良反应发生率不能与另一个临床试验中观察到的不良反应发生率直接比较,也可能不能反映临床实践中的实际发生率。
迄今共获得了来自6项临床试验总计420例受试者暴露于本品的安全性数据,汇总了其中总计245例接受本品剂量为600mg每天1次口服用药方案的Ph+CML慢性期成人患者的安全性数据。常见不良反应(≥2%)及严重程度≥3级的不良反应1包括:
血液及淋巴系统异常:血小板减少(51.4%),白细胞减少(30.2%),中性粒细胞减少(30.2%),贫血(16.3%),淋巴细胞减少(2.0%);≥3级的不良反应包括血小板减少(25.3%),中性粒细胞减少(17.6%),白细胞减少(9.8%),贫血(4.5%),淋巴细胞减少(1.2%);
胃肠系统异常:腹泻(35.1%),腹痛(14.3%),呕吐(12.2%),恶心(8.6%),腹部不适(2.9%),牙疼(2.9%);≥3级的不良反应为腹泻(0.4%);
肝胆系统异常:丙氨酸氨基转移酶升高(22.9%),天门冬氨酸氨基转移酶升高(13.9%),血胆红素升高(11.4%),γ-谷氨酰转移酶升高(8.2%);≥3级的不良反应包括丙氨酸氨基转移酶升高(4.1%),天门冬氨酸氨基转移酶升高(1.6%),γ-谷氨酰转移酶升高(0.8%),血胆红素升高(0.4%);
代谢及营养类异常:血磷降低(11.0%),血钙降低(7.8%),血尿酸升高(6.9%),血甘油三酯升高(4.9%),血钾降低(4.5%),血糖升高(3.7%),血胆固醇升高(2.0%);≥3级的不良反应包括血磷降低(1.2%),血尿酸升高(0.8%),血钾降低(0.8%),血甘油三酯升高(0.4%);
感染和传染:上呼吸道感染(14.3%),肺部感染(2.4%),尿路感染(2.0%);≥3级的不良反应为肺部感染(0.4%);
全身性异常:乏力(5.3%),发热(3.7%),液体潴留(3.7%),胸部不适(3.3%);≥3级的不良反应为胸部不适(0.4%);
肌肉骨骼及结缔组织异常:关节痛(4.1%),肌痛(2.4%),肢体疼痛(2.4%),背痛(2.0%);≥3级的不良反应为背痛(0.4%);
皮肤及皮下组织异常:皮疹(5.7%),瘙痒(3.7%);无≥3级的不良反应;
肾脏及泌尿系统异常:血肌酐升高(6.1%);≥3级的不良反应为血肌酐升高(0.4%);
呼吸系统、胸及纵隔异常:咳嗽(5.3%);无≥3级的不良反应;
神经系统异常:头晕(4.5%),头痛(3.7%);无≥3级的不良反应;
心脏异常:窦性心动过缓(3.3%);无≥3级的不良反应;
耳及迷路类异常:眩晕(2.0%);≥3级的不良反应为眩晕(0.4%);
血管与淋巴管类异常:高血压(2.0%);≥3级的不良反应为高血压(0.4%);
其他检查异常:血清脂肪酶升高(11.0%),心电图检查异常2(7.8%),血清淀粉酶升高(6.5%),血肌酸磷酸激酶升高(4.1%),血碱性磷酸酶升高(3.7%),血乳酸脱氢酶升高(2.4%),其中,≥3级的不良反应包括血清脂肪酶升高(4.9%)和血清淀粉酶升高(1.2%)
注:1指研究者判断为除肯定无关之外的不良事件;2包括窦性心动过缓、心动过缓、室上性期外收缩、房性心动过速、室性期外收缩、阵发性心律失常、窦性心动过速、心电图Q波异常、心电图ST段压低、心电图T波异常和心电图高电压
关键性研究HS-10096-301中的不良反应
HS-10096-301研究是一项多中心、随机、开放、与甲磺酸伊马替尼平行对照的Ⅲ期临床试验。本研究随机入组了400名在之前6个月内首次确诊的费城染色体阳性慢性粒细胞性白血病慢性期(Ph+CML-CP)患者,按1:1比例随机分配到甲磺酸氟马替尼组(600mgqd)或甲磺酸伊马替尼组(400mgqd),ECOG体力状况0~2分;入组前接受过酪氨酸激酶抑制剂(TKI)类药物治疗的患者被排除。受试者的中位年龄为44.9岁,64.3%为男性,35.7%
为女性。
研究中,共196名患者接受了本品治疗。其中190例(96.9%)患者在试验期间发生至少一次不良反应。最常见(≥20%)的不良反应有血小板减少(52.6%)、腹泻(38.8%)、中性粒细胞减少(31.6%)、白细胞减少(31.1%)和丙氨酸氨基转移酶升高(27.6%);82例(41.8%)的患者发生了3级及以上不良反应,常见的(≥2%)有血小板减少(24.5%)、中性粒细胞减少(17.9%)、白细胞减少(9.2%)、脂肪酶升高(5.6%)、贫血(4.6%)、丙氨酸氨基转移酶升高(4.6%)和天门冬氨酸氨基转移酶升高(2.0%)。(表3)
表3HS-10096-301研究中的常见不良反应(≥2%)
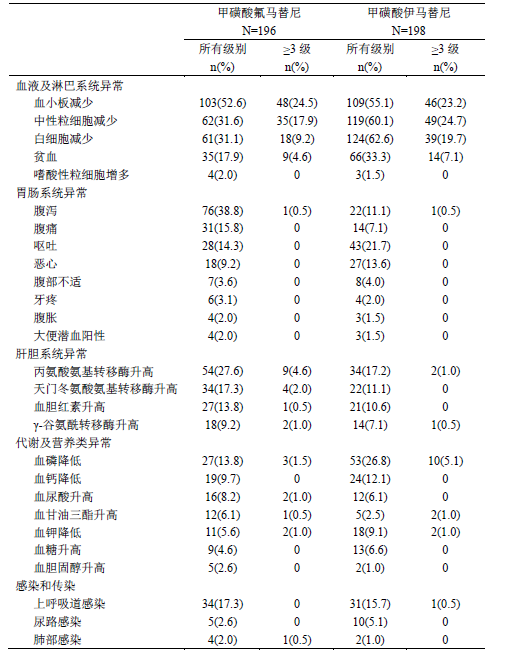
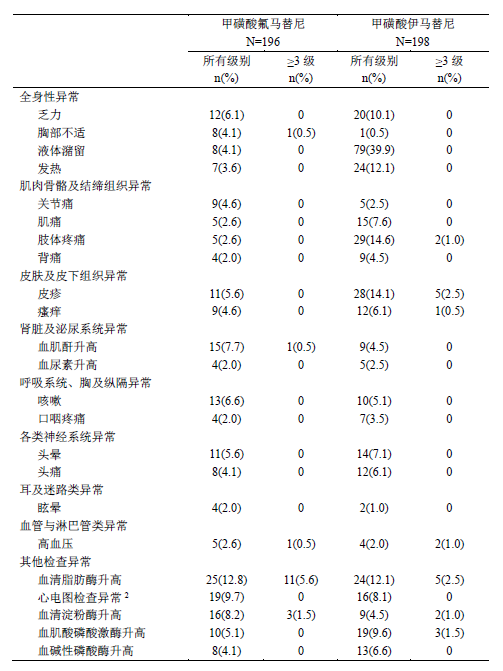
接受本品治疗的患者,19例(9.7%)发生了严重不良反应。严重不良反应(≥1%)包括血小板减少(3.1%)、中性粒细胞减少(1.5%)、丙氨酸氨基转移酶升高(1.5%)和天门冬氨酸氨基转移酶升高(1.0%)。
在接受甲磺酸氟马替尼治疗的患者中,因不良反应导致19.4%的患者进行了剂量下调,39.8%的患者暂停用药。导致剂量下调或暂停用药的常见不良反应(≥2%)有血小板计数降低(21.4%)、中性粒细胞计数降低(10.2%)、丙氨酸氨基转移酶升高(8.7%)、白细胞计数降低(7.1%)、天门冬氨酸氨基转移酶升高(7.1%)、脂肪酶升高(3.1%)和血胆红素升高(2.0%)。9.2%接受甲磺酸氟马替尼治疗的患者因不良反应而终止治疗。导致终止治疗的常见不良反应有血小板计数降低(4.6%)和中性粒细胞计数降低(3.1%)。
部分不良反应描述
骨髓抑制
骨髓抑制十分常见于使用甲磺酸氟马替尼治疗的患者,在HS-10096-301研究中,接受本品治疗的患者骨髓抑制发生率为61.7%。≥3级的骨髓抑制十分常见,主要表现为血小板减少、白细胞减少、中性粒细胞减少和贫血,其中血小板减少最为常见,也是导致甲磺酸氟马替尼剂量下调和停药的最常见原因。发生≥3级骨髓抑制的56例患者经暂停用药等处理措施后均恢复或好转,其中20例(20/56,35.7%)降低剂量后继续治疗,9例(9/56,16.1%)终止治疗。
肝功能异常
在HS-10096-301研究中,接受本品治疗的患者肝功能异常发生率为36.7%,常见肝功能异常包括丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、血胆红素升高和γ-谷氨酰转移酶升高,其中以丙氨酸氨基转移酶升高最为常见。≥3级肝功能异常常见丙氨酸氨基转移酶升高(4.6%)、天门冬氨酸氨基转移酶升高(2.0%)和γ-谷氨酰转移酶升高(1.0%)。
发生≥3级的肝功能异常的10例患者中,9例(9/10,90.0%)患者经暂停用药等处理措施后恢复或好转,其中2例(2/10,20.0%)降低剂量后继续治疗,1例(1/10,10.0%)终止治疗。
心脏毒性
在HS-10096-301研究中,接受本品治疗的患者心脏毒性发生率为10.7%,均为1~2级。
心脏毒性以各类心率失常为主要表现,最常见窦性心动过缓(4.1%),其他包括室上性期外收缩、房性心动过速、室性期外收缩、心悸、阵发性心律失常和窦性心动过速等各类心律失常。2.0%的患者因发生心脏毒性而暂停用药或下调剂量,没有患者因心脏毒性终止治疗。
胃肠道反应
在HS-10096-301研究中,接受本品治疗的患者胃肠道反应发生率为55.1%。主要表现为腹泻(38.8%)、腹痛(15.8%)、呕吐(14.3%)和恶心(9.2%),绝大部分为1~2级,3.6%的患者因胃肠道反应而暂停用药,没有患者下调剂量。
感染
在HS-10096-301研究中,接受本品治疗的患者感染类疾病发生率为22.5%,大多数为1~2级,以上呼吸道感染为主。大多数患者可耐受治疗,无需停药;没有患者因感染降低剂量或终止治疗。
电解质异常
接受甲磺酸氟马替尼治疗的患者常发生电解质异常。在HS-10096-301研究中,接受本品治疗的患者电解质异常发生率为30.1%。常见电解质异常为血磷降低(13.8%)、血钙降低(9.7%)和血钾降低(5.6%),多数为1~2级,大多数患者无需停药或降低剂量。
血清脂肪酶/淀粉酶升高
在HS-10096-301研究中,接受本品治疗的患者常见脂肪酶升高(12.8%)和/或淀粉酶升高(8.2%)。淀粉酶升高程度轻,以1~2级为主;≥3级的脂肪酶升高常见(5.6%),并导致3.1%的患者停药,1.5%的患者下调剂量。血清脂肪酶/淀粉酶升高可伴有腹部症状,也可为无症状血清脂肪酶/淀粉酶升高,需注意与胰腺炎鉴别(见【注意事项】)。
禁忌:
对本品活性成份或任何一种辅料过敏者,禁用本品。
注意事项:
骨髓抑制
骨髓抑制十分常见于使用本品治疗的患者(见【不良反应】)。在本品治疗的第1个月,宜每周检测一次全血细胞计数,第2个月每2周检测一次全血细胞计数,之后可每个月检测一次全血细胞计数,或视需要而定。发生严重中性粒细胞减少或血小板减少时,应调整剂量(见【用法用量】)。若为3~4级贫血,一般不需停药或降低剂量。
肝功能异常
开始治疗前应检查肝功能(转氨酶、胆红素和碱性磷酸酶),随后每月检查一次或根据临床需要监测,必要时应调整剂量(见【用法用量】)。对轻、中、重度肝功能损害患者应监测其肝功能。
如果高胆红素症是间接胆红素升高引起的(即直接胆红素≤1.5×ULN),需注意排除溶血性疾病,并监测血清淀粉酶和脂肪酶水平。在淀粉酶和脂肪酶均正常的情况下,可以相同剂量继续治疗,治疗期间注意监测。
心脏毒性
本品存在心脏毒性,主要表现为心律失常。出现2级及以上不良反应时,应及时暂停给药、降低剂量或终止治疗(见【用法用量】)。
本品临床试验中未发生QT间期延长,同类药物有QT间期延长的不良反应报道,因此这可能是潜在的安全性风险,需在用药过程中密切观察。一旦出现QT间期延长,应首先暂停用药,检测血钾、血镁浓度,如低于正常值下限,补钾/镁至正常水平。评价伴随药物的使用情况,并核对检查甲磺酸氟马替尼的用法和用量是否正确。在首次发现QTc>480ms后,应尽快进行一次心电图(ECG)检查,如果QTc仍>480ms,则需重复ECG检查,至少每日一次,直到QTc回到<480ms。如果QTc在14天内恢复到<450ms,且较基线值延长≤20ms,则以相同剂量继续治疗;如QTc在450~480ms之间或较基线值延长>20ms,且持续>14天,或者重新治疗后,QTc再次超过450ms,但未超过480ms,则应降低1级剂量水平继续治疗(见【用法用量】)。如果继续治疗后,QTc再次超过480ms,则终止治疗。QTc>480ms并持续>14天,必须终止治疗。
同类产品存在左心室射血分数(LVEF)减少或充血性心力衰竭的不良反应。本品在临床试验中尚未发现。对有心血管疾病风险或有心脏疾病的患者应严密监测,应用本品治疗的老年患者或有心脏疾病史的患者,应首先测定左心室射血分数(LVEF),在治疗期间,患者有明显的心衰症状时应全面检查,根据临床症状进行相应的治疗,同时参照【用法用量】调整治疗。
血清脂肪酶和/或淀粉酶升高
本品治疗过程中,可出现血清脂肪酶和/或淀粉酶升高,可伴有腹部症状或无症状。出现血清脂肪酶和/或淀粉酶升高时,应首先停药观察,并完善腹部CT检查,以排除胰腺病变,建议有胰腺炎病史的患者慎用。使用本品时应定期监测血清脂肪酶和淀粉酶,如果出现2级及以上的血清脂肪酶和/或淀粉酶升高,在第1次发生时,应立即停药观察,在恢复到≤1级后,降低1级剂量水平继续治疗(见【用法用量】);当第2次发生或恢复到≤1级的时间超过28天,应终止治疗。
出血
在血液系统恶性疾病中,出血是常见的并发症,可能是由于血小板减少,或血小板功能异常造成的。服用本品的患者中,报告了与药物相关的出血事件。3级及以上的出血包括月经量过多、子宫出血、大脑出血,其他出血表现包括瘀斑、血尿。如患者需要服用抑制血小板功能的药物或抗凝药,应谨慎。
液体潴留
同类其他产品存在严重液体潴留的不良反应。本品的临床试验中,受试者发生的液体潴留主要表现为浅表水肿,如面部水肿、眼睑浮肿、眼睑水肿等,均为1级(见【不良反应】)。
在服用本品过程中,建议监测体重,出现非预期的快速体重增加,需要警惕液体潴留的可能,建议及时就医明确诊断。液体潴留可以加重或导致心衰,目前尚无严重心衰患者(按纽约心脏学会分类法的Ⅲ~Ⅳ级)临床应用甲磺酸氟马替尼的经验。有心脏病、心力衰竭风险因素或肾衰竭病史的患者慎用本品。青光眼患者建议慎用。
低磷血症
接受甲磺酸氟马替尼治疗的患者,常发生电解质异常,其中最常见为血磷降低(见【不良反应】)。用药期间如发生1~2级的低磷血症,注意密切监测,无需特殊处理;如发生≥3级低磷血症(<2.0mg/dL或<0.6mmol/L),建议停药观察,并补充磷酸盐,在恢复到≤2级后,可以相同剂量继续治疗;如再次发生,以相同方式进行处理,直到恢复到≤2级后,建议降低1级剂量水平(见【用法用量】)继续治疗;如第3次发生,应终止治疗。
特殊人群
肝功能损害
肝功能损害者慎用本品。目前尚无严重肝功能损害患者使用600mg/天剂量的数据资料。
轻、中度肝功能损害者推荐使用最大剂量600mg/天。严重肝功能损害者,在经医生评估获益大于风险后,才能谨慎使用甲磺酸氟马替尼。
肾功能损害
尚未在肾功能损害患者中进行临床研究。本品及其代谢产物只有少部分经肾排泄,预期肾功能损害患者并不会出现总体清除率的降低,建议在医生指导下使用。
对驾驶和操作机器能力的影响
尚未进行研究来评价甲磺酸氟马替尼对驾驶和操作机器能力的影响。由于可能出现乏力、头晕、眩晕等不良反应,建议患者在服用本品期间驾驶或操作机器时应谨慎。
孕妇及哺乳期妇女用药:
妊娠
目前尚缺乏孕妇使用甲磺酸氟马替尼的临床资料,对胎儿可能的毒性目前不详。仅在预期获益超过胎儿潜在风险时,可在妊娠期间使用。如妊娠期间服用甲磺酸氟马替尼,必须告知其对胎儿可能的危害。育龄期妇女在服用甲磺酸氟马替尼期间,建议同时采取有效的避孕措施。
哺乳期妇女
目前尚缺乏甲磺酸氟马替尼是否经人乳汁排泄的资料。
生殖力
目前尚缺乏甲磺酸氟马替尼对于男性和女性生育能力影响的资料。
儿童用药:
目前尚缺乏18 岁以下患者使用甲磺酸氟马替尼的安全性和有效性资料。
老年用药:
对老年患者无需因为年龄因素进行剂量调整。
药物相互作用:
尚未在人体进行药物相互作用的研究。
非临床研究结果显示,CYP3A4 是氟马替尼的主要代谢酶,同时本品对CYP3A4 酶的抑制具有时间依赖性。临床治疗期间应慎用对CYP3A4 酶有强诱导作用(如利福平、卡马西平和苯妥英钠等)和强抑制作用(如克拉霉素等大环内酯类抗菌药物、伊曲康唑等三唑类抗真菌药物和抗HIV 药洛匹那韦等蛋白酶抑制剂)的药物,请在医生指导下使用。
药物过量:
尚无本品过量用药后出现特殊症状和体征的报告及相关临床治疗经验。若发生药物过量,应对患者进行密切监护,给予对症治疗。
在Ⅰ期耐受性临床研究中,有17 例CML 慢性期患者暴露在800mg 剂量水平及以上(包括每日1 次和每日2 次给药方式),3 级及以上不良反应有血液学毒性(白细胞降低2 例、中性粒细胞降低2 例、血小板降低2 例和血红蛋白降低1 例)、胃肠道反应(腹泻3 例)和肝功能异常(γ-谷氨酰转移酶升高1 例),这些不良反应经对症处理后,患者均恢复正常。
临床试验:
慢性髓性白血病慢性期(CML-CP)Ⅲ期临床研究(HS-10096-301)
该研究是在Ph+CML-CP患者中进行的一项多中心、随机、开放、以伊马替尼为阳性对照的Ⅲ期临床试验。研究共纳入393例患者(全分析集,FAS),其中196例患者接受氟马替尼600mg/天口服治疗;197例患者接受伊马替尼400mg/天口服治疗;均治疗12个周期。
中位年龄氟马替尼组为44.9岁,伊马替尼组为45.2岁;男性比例两组分别为64.3%和60.4%;Sokal评分两组比例相似(低危:26.0%vs26.4%;中危:67.9%vs66.5%;高危:6.1%vs7.1%)。
氟马替尼组中位治疗时间为335.0天,伊马替尼组为334.5天;中位随访时间分别为336天和335天。
结果显示氟马替尼组的6周期主要分子学缓解率(MMR%)高于伊马替尼组[FAS:33.67%vs18.27%,P=0.0005,率差(95%CI):15.40%(6.86%~23.94%)]。12周期MMR%氟马替尼组高于伊马替尼组[FAS:48.47%vs32.99%,P=0.0021,率差(95%CI):15.47%(5.88%~25.07%)]。氟马替尼组和伊马替尼组随机至主要分子学缓解(MMR)的中位时间分别为8.5个月和11.3个月,氟马替尼组早于伊马替尼组发生(P=0.0008)。
在完全细胞遗传学缓解率(CCyR%)方面,氟马替尼组和伊马替尼组在3周期末分别为41.84%和34.52%;在6周期末两组分别为60.71%和49.75%;在12周期末两组分别为65.31%和60.41%。在完全分子学缓解率(CMR%)上,氟马替尼组和伊马替尼组在6周期末分别为8.67%和3.55%;在12周期末分别为20.92%和9.64%。
氟马替尼组和伊马替尼组的中位无进展生存期、中位无事件生存期和中位无转化生存期在访视至12周期末时均未达到。
贮藏:
密封,在30℃以下保存。
包装:
(1)0.1g:铝塑包装,10 片/板×1 板/盒。
(2)0.2g:铝塑包装,10 片/板×1 板/盒,10 片/板×3 板/盒。
有效期:
24 个月。
执行标准:
YBH02562019
批准文号:
(1)0.1g:国药准字H20190032
(2)0.2g:国药准字H20190033
生产企业:
江苏豪森药业集团有限公司