
【通用名称】 阿可替尼胶囊
【商品名称】 康可期
【汉语拼音】 A Ke Ti Ni Jiao Nang
成份:
本品活性成份为阿可替尼。
化学名称:4-{8-氨基-3-[(2S)-1-(丁-2-炔酰基)吡咯烷-2-基]咪唑并[1,5-a]吡嗪-1-基}-N-(吡啶-2-基)苯甲酰胺
化学结构式:
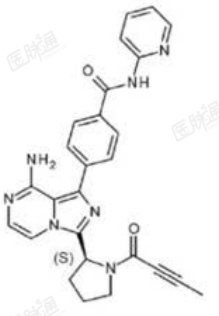
分子式:C26H23N7O2
分子量:465.51
辅料:微晶纤维素胶态二氧化硅共处理物、预胶化淀粉、硬脂酸镁、羧甲淀粉钠、明胶空心胶囊
所属类别:
化药及生物制品 >> 其他 >> 其他
适应症:
本品单药适用于:
既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。
既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。基于单臂临床试验的主要缓解率结果附条件批准本适应症,常规批准将取决于正在开展中的确证性随机对照临床试验结果。
规格:
100 mg
用法用量:
本品应当在有抗肿瘤治疗经验医生的监督下使用。
推荐剂量
本品推荐剂量为 100 mg(1 粒胶囊),每日两次。
两次给药之间应间隔约 12 小时。
可持续使用本品治疗,直至出现疾病进展或不可耐受的毒性。
给药方法
本品应尽可能在每天同一时间用水整粒吞服,可与或不与食物同服。不应咀嚼、溶解或打开胶囊。
药物漏服
如果患者漏服一剂本品超过 3 小时,则不应补服遗漏的剂量,应指导患者在其定期服药的时间服用下一剂。
剂量调整
不良反应
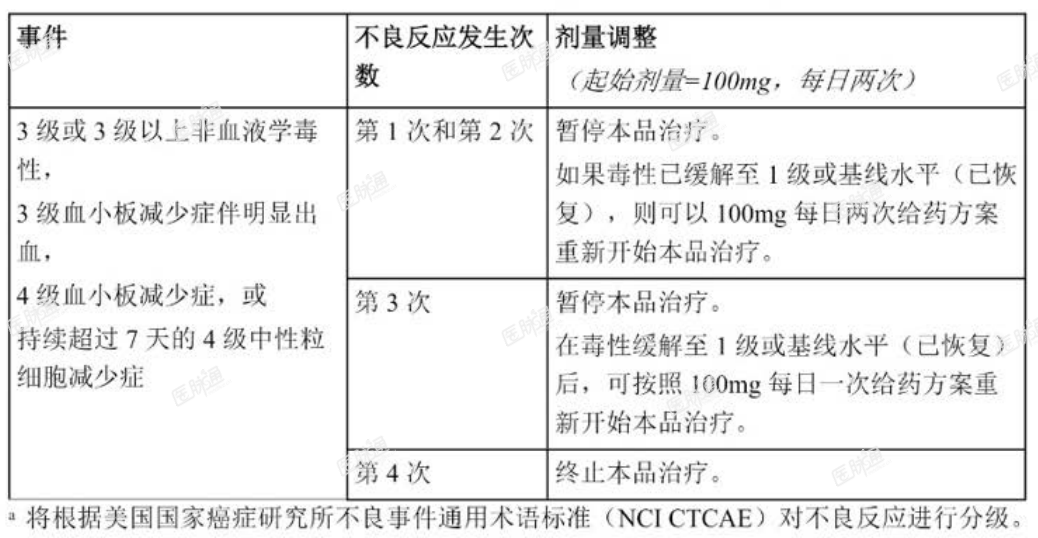
针对 3 级或 3 级以上不良反应,推荐的阿可替尼胶囊剂量调整方案请见表 1。
表 1. 针对不良反应a推荐的剂量调整方案
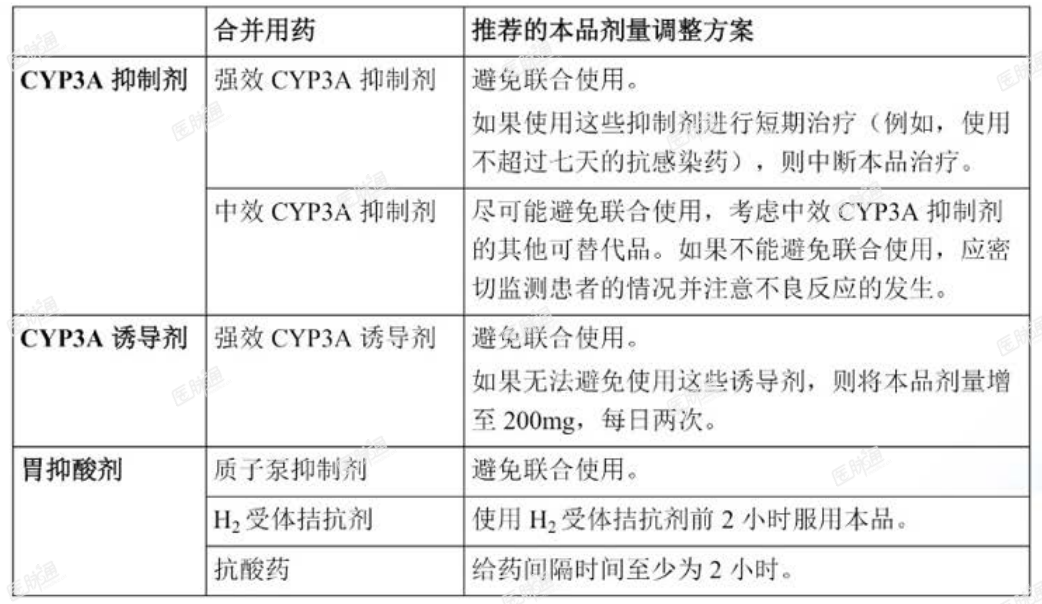
与 CYP3A 抑制剂或诱导剂以及胃抑酸剂合并使用期间采用的剂量调整方案
推荐的剂量调整方案请见下表 2(另见【药物相互作用】)。
表 2. 与 CYP3A 抑制剂或诱导剂以及胃抑酸剂联合使用
特殊人群
肾功能损伤
尚未在肾功能损伤患者中开展特定的临床研究。本品临床研究中,轻度或中度肾功能损伤患者接受了治疗。轻度或中度肾功能损伤患者(肌酐清除率>30 mL/min),不建议调整剂量,保持喝水,并定期监测血清肌酐水平。对于重度肾功能损伤患者(肌酐清除率 < 30 mL/min),仅在获益超过风险时给予本品治疗,并应密切监测这些患者的毒性迹象。目前尚无重度肾功能损伤患者或透析患者使用本品的数据(见【临床药理】项下药代动力学)。
肝功能损伤
轻度或中度肝功能损伤患者(Child-PughA 级,Child-PughB 级,或总胆红素介于正常值上限[ULN]的 1.5-3 倍之间、以及 AST 为任何数值),不建议调整剂量。但应密切监测中度肝功能损伤患者的不良反应。重度肝功能损伤患者(Child-PughC 级,或总胆红素>3 倍 ULN、以及 AST 为任何数值),不建议使用本品(见【临床药理】项下药代动力学)。
重度心脏疾病
重度心血管疾病患者未纳入本品临床研究中。
老年人
老年患者(>65 岁)无需调整剂量(见【临床药理】项下药代动力学)。
儿童
尚无本品用于 18 岁以下患者的临床研究资料。
不良反应:
以下不良反应的详细内容请参见【注意事项】。
·出血
·感染
·各种血细胞减少症
·第二种原发恶性肿瘤
·房颤房扑
临床试验经验
由于各项临床试验的实施条件不尽相同,因此在一项药物的临床试验中观察到的不良反应发生率不能直接与另一项药物临床试验中观察到的不良反应发生率进行比较,并且可能并不反映实践中观察到的不良反应发生率。
安全性信息汇总
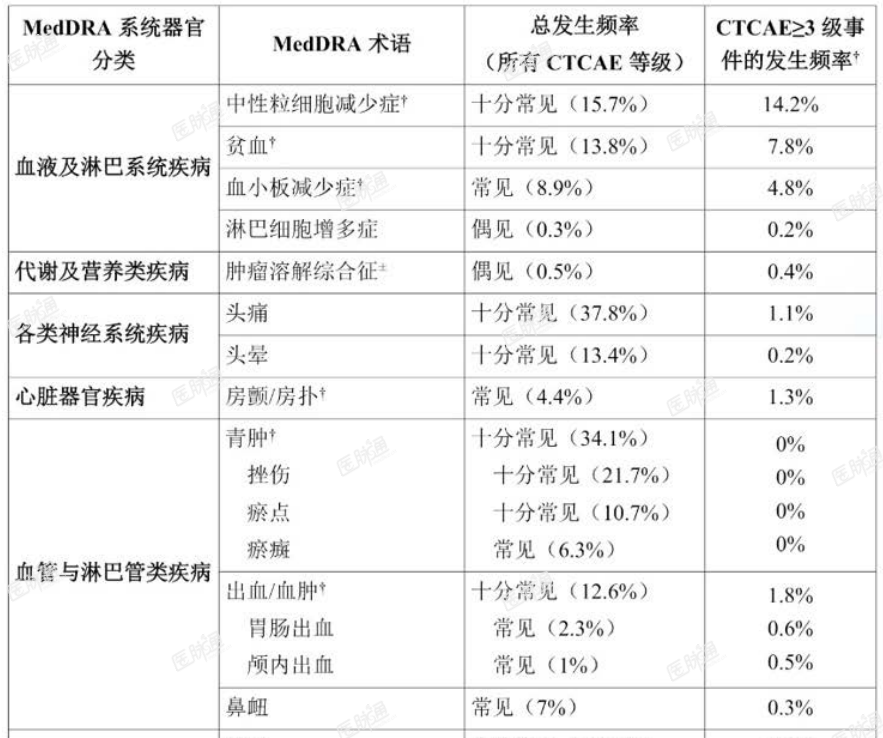
本品的总体安全性特征是基于 1040 例在临床试验中接受本品单药治疗的恶性血液疾病患者的汇总数据。本品治疗患者时最常见(>20%)的任何级别的药物不良反应包括:感染、头痛、腹泻、青肿、骨骼肌肉疼痛、恶心、疲乏和皮疹。最常报告的(>5%)>3 级药物不良反应包括感染(17.6%)、中性粒细胞减少症(14.2%)和贫血(7.8%)。
4.2% 的患者报告了因不良事件导致剂量降低。9.3% 的患者报告了因不良事件导致永久停药。中位剂量强度为 98.7%。
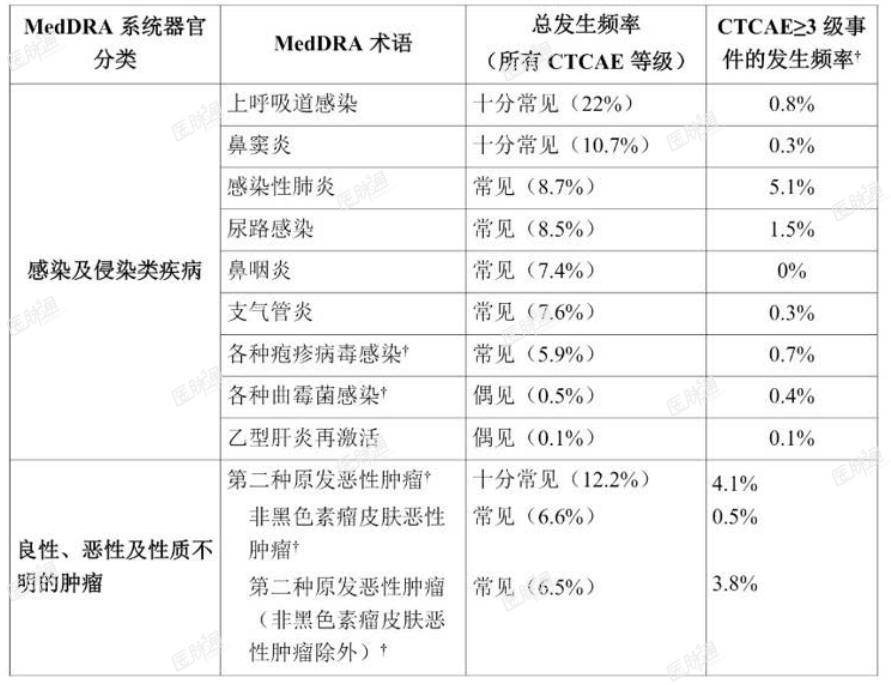
不良反应汇总列表
在接受本品治疗的恶性血液疾病患者中已确认以下药物不良反应。汇总数据集中,本品治疗的中位持续时间为 26.2 个月。
药物不良反应根据 MedDRA 的系统器官分类(SOC)列出并按发生频率排序,发生频率最高的列在首位。此外,药物不良反应发生频率分类定义为:十分常见(>1/10);常见(>1/100-<1/10);偶见(>1/1000-<1/100);罕见(>1/10000-<1/1000);十分罕见(<1/10000);未知(无法根据现有数据进行预估)。各发生频率分组中,不良反应按严重度降序列出。
表 3. 接受阿可替尼单药治疗的恶性血液疾病患者(n = 1040)的药物不良反应
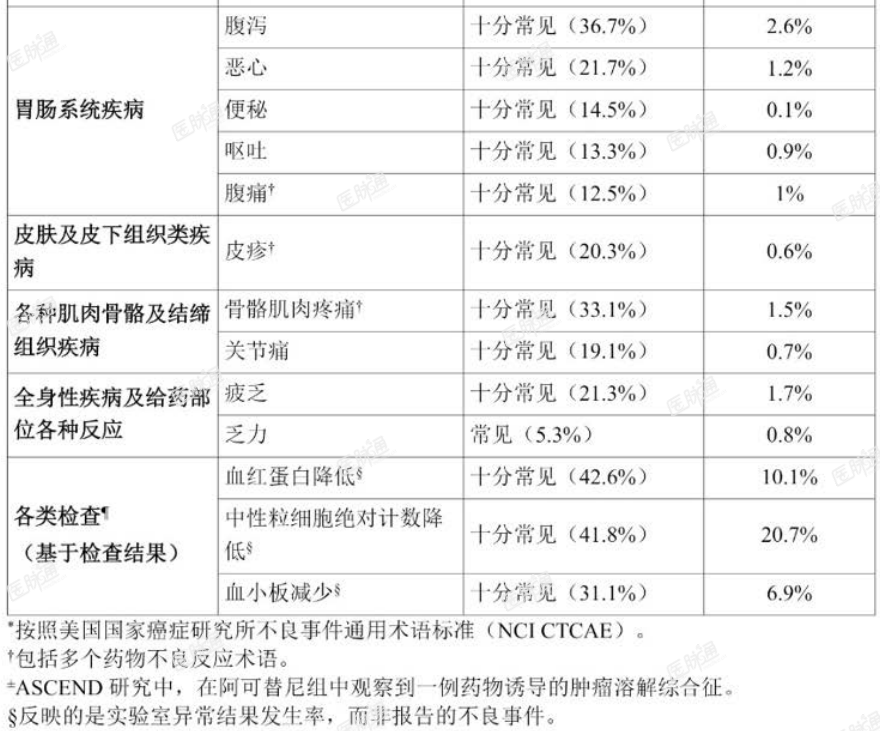
本品在套细胞淋巴瘤患者中的安全性特征,是基于 ACE-LY-004 研究中 124 例既往接受过治疗的套细胞淋巴瘤患者,在接受阿可替尼 100 mg,每日两次治疗后的安全性数据。阿可替尼中位治疗时间为 16.6 个月(范围:0.1-26.6 个月)。共计 91 例(73.4%)患者接受阿可替尼治疗 ≥ 6 个月,74 例(59.7%)患者接受治疗 ≥ 1 年。
最常见(>20% 患者报告)的任何级别的不良反应包括:贫血、血小板减少症、头痛、中性粒细胞减少症、腹泻、疲乏、肌痛和青肿。最常见的 1 级非血液学不良反应包括:头痛(25%)、腹泻(16%)、疲乏(20%)、肌痛(15%)和青肿(19%)。最常见(>2% 患者报告)的>3 级非血液学不良反应为腹泻。
1.6% 的患者因不良反应导致剂量减少;6.5% 的患者因不良反应导致终止治疗。
基于 ACE-LY-004 研究数据,从套细胞淋巴瘤患者中观察到的安全性特征与阿可替尼单药治疗在其他恶性血液疾病患者中观察到的安全性特征一致。
特定的不良反应描述
因不良反应导致停药和剂量减少
在接受本品单药治疗的 1040 例患者中,9.3% 的患者报告了因不良反应导致停药。这些不良反应主要包括感染性肺炎、血小板减少症和腹泻。4.2% 的患者报告了因不良反应导致剂量减少。这些不良反应主要包括乙型肝炎再激活、脓毒症和腹泻。
禁忌:
对本品活性物质或任何辅料成份过敏者禁用。
注意事项:
出血
在接受本品单药治疗的恶性血液疾病患者中发生了重要出血事件,其中包括中枢神经系统和胃肠道出血,其中一些事件具有致死性结局。上述事件在件和不伴血小板减少症的患者中均有发生。总体上,出血事件严重程度不高,包括挫伤和瘀斑(见【不良反应】)。
目前,尚未全面了解阿可替尼引起出血事件的机制。
接受抗血栓药治疗的患者中,出血风险可能会增加。慎用抗血栓药,在医学上需联合用药时,需考虑对出血体征进行额外监测。华法林或其他维生素 K 拮抗剂不应与本品联合使用。
围手术期患者,应该评估在术前和术后至少 3 天暂停阿可替尼的获益和风险。
感染
在接受本品单药治疗的恶性血液疾病患者中,发生了严重感染(细菌、病毒或真菌),包括致死性事件。上述感染主要发生在无 3 或 4 级中性粒细胞减少的情况下,所有患者中 1.9% 报告了中性粒细胞减少性感染。已发生因乙型肝炎病毒(HBV)和带状疱疹病毒(HZV)再激活引起的感染、曲霉菌感染和进行性多灶性白质脑病(PML)(见【不良反应】)。
病毒再激活
在接受本品治疗的患者中已有乙型肝炎再激活的病例报告。在开始使用本品治疗前应确认乙型肝炎病毒(HBV)状态。如果患者乙型肝炎血清学检测呈阳性,应在开始治疗前咨询肝病专家,并应按照当地医疗标准对患者进行监测和管理,以防止乙型肝炎再激活。
在既往使用或联合使用免疫抑制治疗的情况下,使用本品已有进行性多灶性白质脑病(PML)的病例报告,包括致死性病例。医生应在有新发或恶化的神经、认知或行为体征或症状的患者中,考虑针对 PML 进行鉴别诊断。如果怀疑 PML,则应进行适当的诊断评估,并应暂停本品治疗,直至排除 PML。如果存在任何疑问,应考虑转诊神经科医师并采取适当的 PML 诊断措施,包括 MRI 扫描(优选对比增强 MRI)、脑脊液(CSF)检测 JC 病毒 DNA 和重复进行神经学评估。
对于机会性感染风险增加的患者,应考虑根据标准治疗进行预防。应监测感染体征和症状,并适当的治疗。
各种血细胞减少症
在接受本品单药治疗的恶性血液疾病患者中,发生了治疗中出现的 3 或 4 级各种血细胞减少症,包括中性粒细胞减少症、贫血和血小板减少症(见【不良反应】)。按医疗需求监测全血细胞计数。
第二种原发恶性肿瘤
在接受本品单药治疗的恶性血液疾病患者中发生了第二种原发恶性肿瘤,包括皮肤癌和非皮肤部位的各类癌症(见【不良反应】)。常见为皮肤癌。监测患者有无皮肤癌外观,并建议避免日光暴露。
房颤房扑
在接受本品单药治疗的恶性血液疾病患者中发生了房颤房扑。监测房颤和房扑的症状(如心悸、头晕、晕厥、胸痛、呼吸困难),并根据医疗需求进行心电图检查。对于在本品治疗中发生房颤的患者,应对血栓栓塞性疾病的风险进行全面评估。在血栓栓塞性疾病高风险患者中,应考虑使用抗凝剂进行严格控制治疗,并考虑本品的替代治疗选择(见【药物相互作用】和【用法用量】)。
其他药物
强效 CYP3A 抑制剂与本品联合给药可能导致阿可替尼暴露量增加,因此毒性风险更高,相反,与 CYP3A 诱导剂合并给药可能导致阿可替尼暴露量减少,并因此导致有效性缺乏的风险。应避免合并使用强效 CYP3A 抑制剂。如果这些抑制剂用于短期治疗(例如,使用抗感染药最多七天),应暂停本品治疗。如果无法避免使用中效 CYP3A 抑制剂,应密切监测患者的毒性迹象(见【用法用量】和【药物相互作用】)。由于有效性缺乏的风险,应避免与强效 CYP3A4 诱导剂同时使用。
本品含钠
本品每剂含 < 1mmol 钠(23 mg),即基本“无钠”。
孕妇及哺乳期妇女用药:
避孕
有生育能力的女性服用本品期间应避免妊娠。
孕妇
尚无孕妇使用阿可替尼的数据。基于动物研究的结果,妊娠期间暴露于阿可替尼可能导致胎儿危害。在大鼠中观察到难产(分娩困难或产程延长),并在妊娠家兔中观察到与给药相关的胎儿生长减缓(见【药理毒理】)。
除非患者的临床情况必须使用阿可替尼治疗,否则妊娠期间应禁用本品。
生育力
尚无本品对人类生育力影响的相关数据。在雄性和雌性大鼠的阿可替尼非临床研究中,未观察到对生育力参数的不利影响(见【药理毒理】)。
哺乳期妇女
尚不清楚阿可替尼是否通过人类乳汁排泄。尚无阿可替尼对母乳喂养婴儿或对乳汁分泌影响的数据。哺乳期大鼠的乳汁中存在阿可替尼及其活性代谢产物。不能排除对婴儿的风险。建议哺乳母亲在本品治疗期间和末次给药后 2 天内不要哺乳。
儿童用药:
尚未确定本品在 18 岁以下患者中的安全性和有效性。
老年用药:
在本品临床研究中接受单药治疗的 1040 例患者中,年龄>65 岁且 < 75 岁的患者占比 41%,年龄>75 岁的患者占比 22%。在>65 岁患者和年轻患者之间,未观察到安全性或有效性存在有临床意义的差异。
药物相互作用:
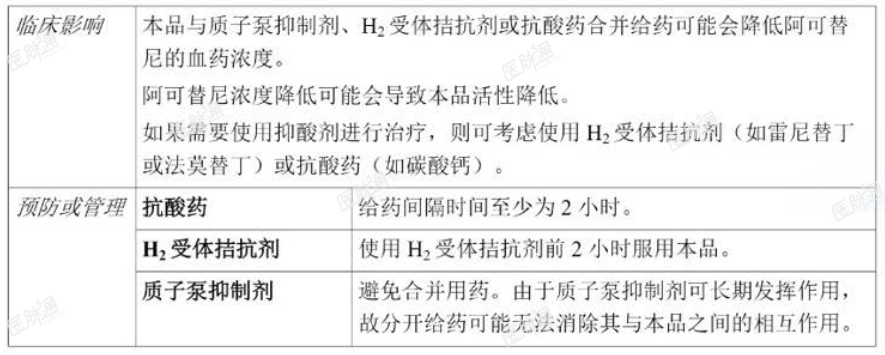
与 CYP3A 抑制剂和诱导剂或胃抑酸剂之间的相互作用
有关与 CYP3A 抑制剂和诱导剂或胃抑酸剂之间相互作用的临床影响以及预防或管理方案分别见下文表 4 和表 5。另见【用法用量】以及【临床药理】项下药代动力学。
表 4. 与其他药物的相互作用-CYP3A 抑制剂和诱导剂
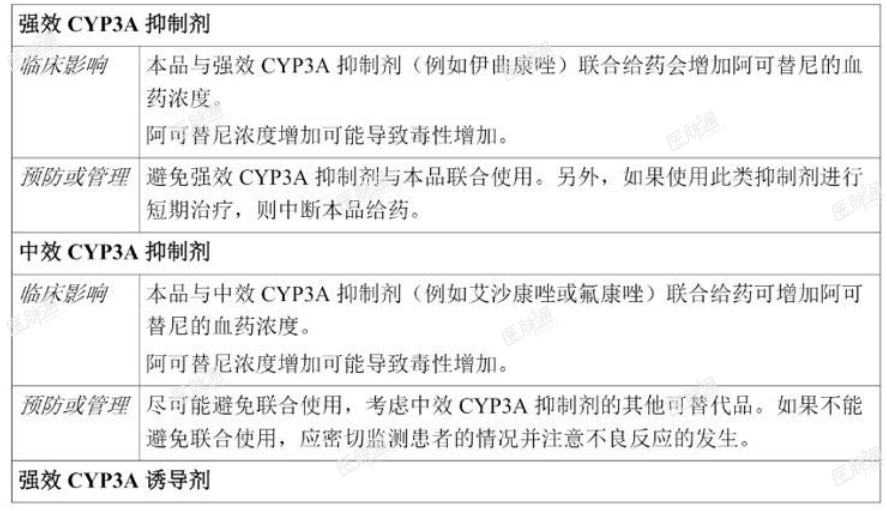

表 5. 与其他药物的相互作用-胃抑酸剂
阿可替尼及其活性代谢产物 ACP-5862 对 CYP450 和 UGT 酶的影响
体外数据表明,在治疗剂量浓度水平下,阿可替尼或 ACP-5862 未对 CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4/5、UGT1A2 或 UGT2B7 产生相关抑制作用。阿可替尼是 CYP1A2、CYP2B6 和 CYP3A4 的弱诱导剂;ACP-5862 对 CYP3A4 的诱导作用较弱。
阿可替尼及其活性代谢产物 ACP-5862 对药物转运系统的影响
阿可替尼可能通过抑制肠道 BCRP 来增加联合给予的 BCRP 底物药物(例如甲氨蝶呤)的暴露量。
ACP-5862 可能通过抑制 MATE1 来增加联合给予的 MATE1 底物药物(例如二甲双胍)的暴露量。
体外研究显示,阿可替尼和 ACP-5862 均为 P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)的底物。阿可替尼不是肾摄取性转运蛋白 OAT1、OAT3 和 OCT2 或肝转运蛋白 OATP1B1 和 OATP1B3 的底物。ACP-5862 不是 OATP1B1 或 OATP1B3 的底物。在临床浓度水平下,阿可替尼和 ACP-5862 不会对 P-gp、OAT1、OAT3、OCT2、OATP1B1、OATP1B3 和 MATE2-K 产生抑制作用。
药物过量:
尚无针对阿可替尼用药过量的特定治疗方案,并且尚未确定用药过量的症状。若出现用药过量,须密切监测患者是否出现不良反应的体征或症状,并进行适当的对症治疗。
临床试验:
慢性淋巴细胞白血病(CLL)
在 310 例既往至少接受过一种治疗的复发性或难治性 CLL 患者中进行了一项随机、多中心、开放性 III 期研究(ASCEND,ACE-CL-309),评价了本品在这些患者中的安全性和有效性。患者接受阿可替尼单药治疗或研究者选择的 Idelalisib + 利妥昔单抗或苯达莫司汀 + 利妥昔单抗。该试验允许患者接受华法林以外的抗血栓药物或等效的维生素 K 拮抗剂。
患者以 1:1 的比例随机接受:
·阿可替尼 100 mg,每日两次,直至疾病进展或出现不能耐受的毒性,或
·研究者选择的治疗:
o在每个 28 天周期的第 1 天给予 Idelalisib 150 mg,每日两次(直至疾病进展或出现不能耐受的毒性) + 利妥昔单抗,输注 < 8 次(首剂 375 mg/m2,随后 500 mg/m2),最长持续 6 个周期
o在每个 28 天周期的第 1 天给予苯达莫司汀 70 mg/m2(每个 28 天周期的第 1 天和第 2 天) + 利妥昔单抗(首剂 375 mg/m2,随后 500 mg/m2),最长持续 6 个周期
按 17p 缺失状态(是 vs.否)、ECOG 体能状态(0 或 1vs.2)和既往治疗数(1-3vs.>4)对患者分层。表 6 总结了研究人群的基线人口学和疾病特征。
表 6. ASCEND(ACE-CL-309)研究中 CLL 患者的基线特征
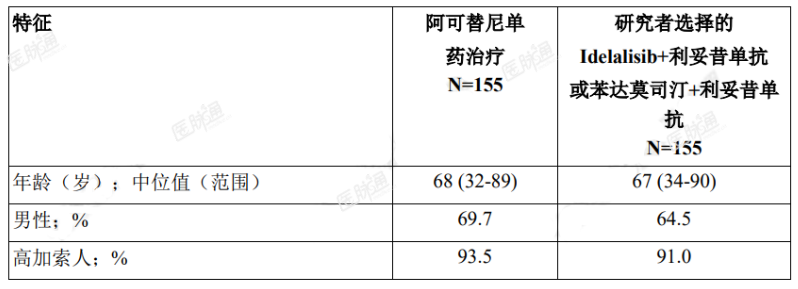
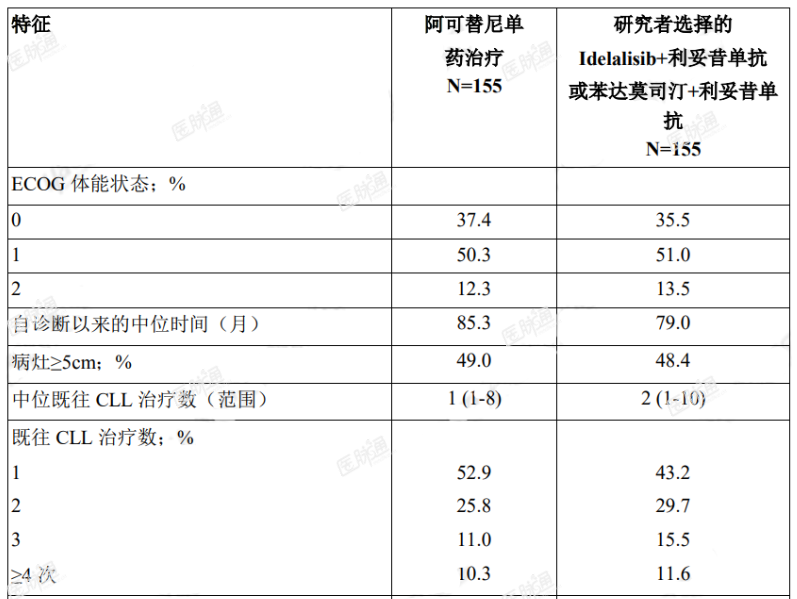
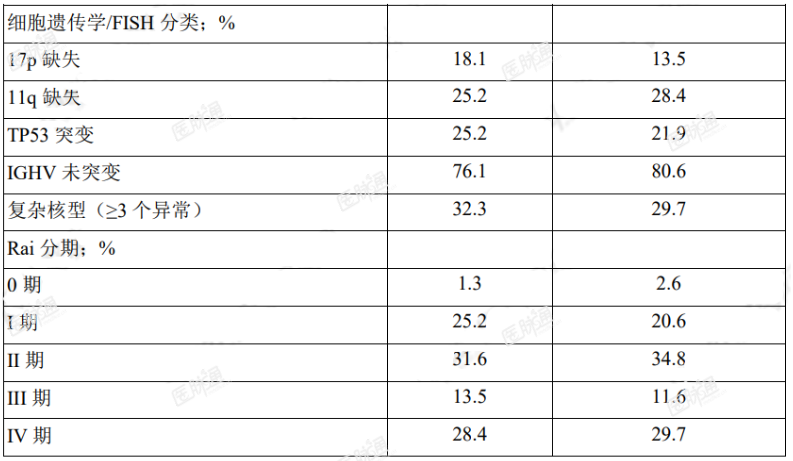
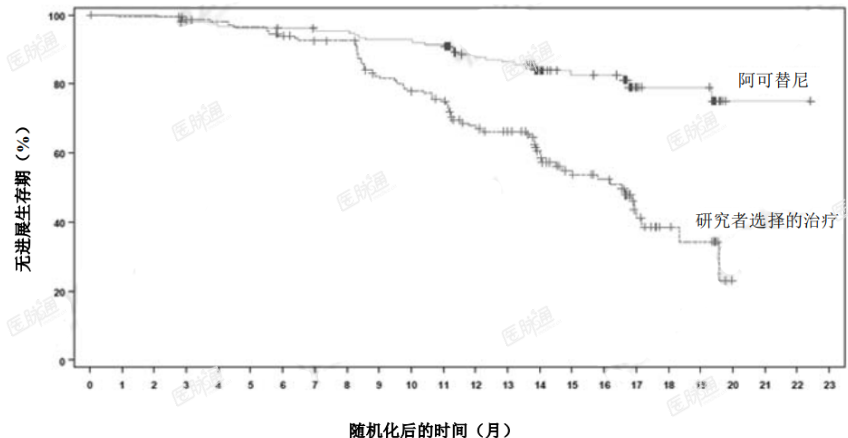
主要终点为 PFS,由 IRC 根据 2008 年 iwCLL 标准(纳入了治疗相关淋巴细胞增多症的说明)进行评估(Cheson2012)。中位随访达 16.1 个月时,PFS 结果显示阿可替尼组患者出现死亡或进展的风险降低 69%,有效性结果参见表 7。IRC 评估 PFS 的 Kaplan-Meier 曲线见图 1。
表 7. ASCEND(ACE-CL-309)研究 CLL 患者中的有效性结果
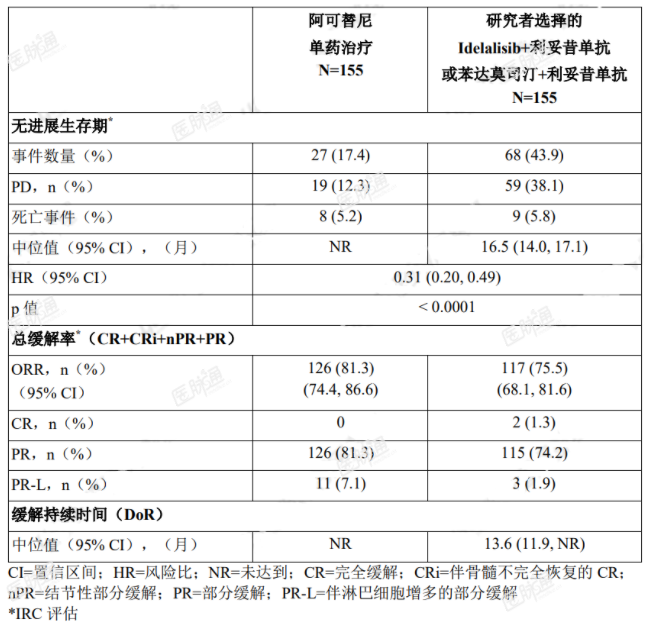
图 1. ASCEND(ACE-CL-309)研究 CLL 患者 PFS(经 IRC 评估)的 Kaplan-Meier 曲线(ITT)

最终分析时,中位随访时间约为 46.5 个月,有效性结果参见表 8。研究者评估 PFS 的 Kaplan-Meier 曲线见图 2。
表 8. 最终分析时 ASCEND(ACE-CL-309)研究 CLL 患者的有效性结果(经 INV 评估)
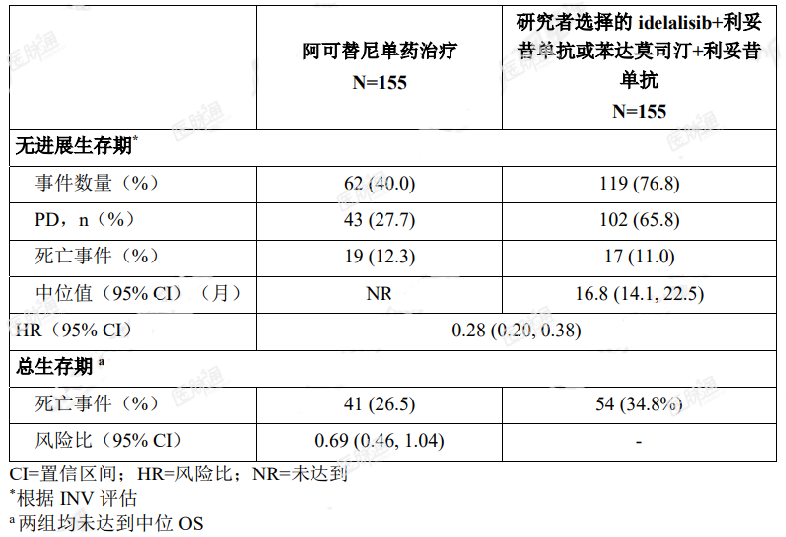
图 2. ASCEND(ACE-CL-309)研究 CLL 患者 PFS(经 INV 评估)的 Kaplan-Meier 曲线(ITT)
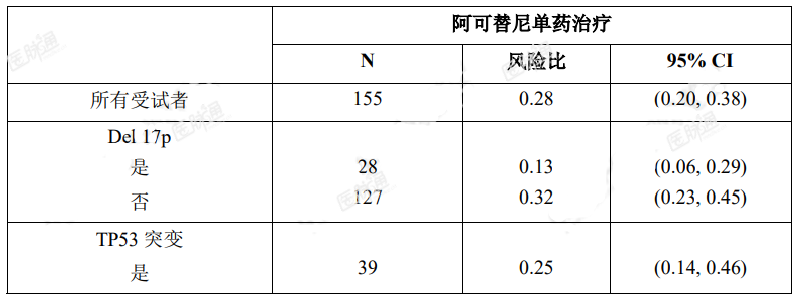
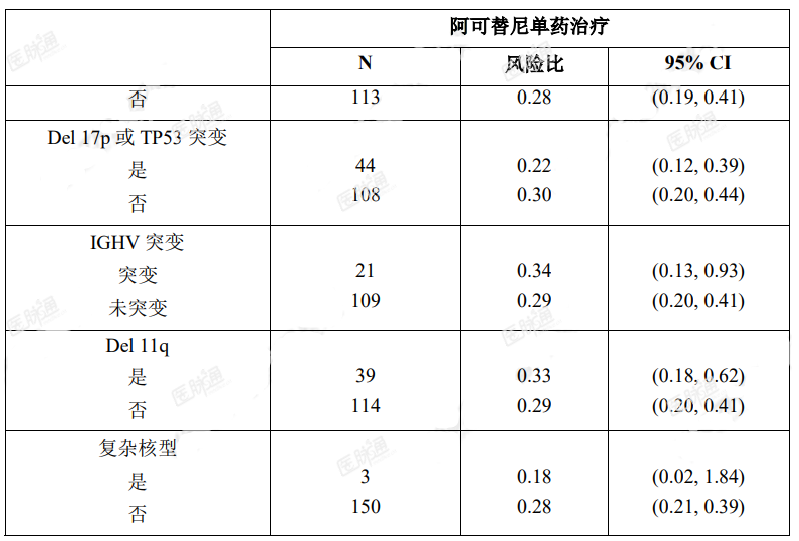
最终分析时,亚组间阿可替尼的 PFS 结果(经研究者评估)一致。在高危 CLL 人群(17p 缺失、11q 缺失、TP53 突变、IGHV 未突变)中,PFS(经研究者评估)HR 为 0.26[95%CI(0.19,0.37)]。
表 9. ASCEND(ACE-CL-309)研究 PFS(经 INV 评估)亚组分析
套细胞淋巴瘤(MCL)
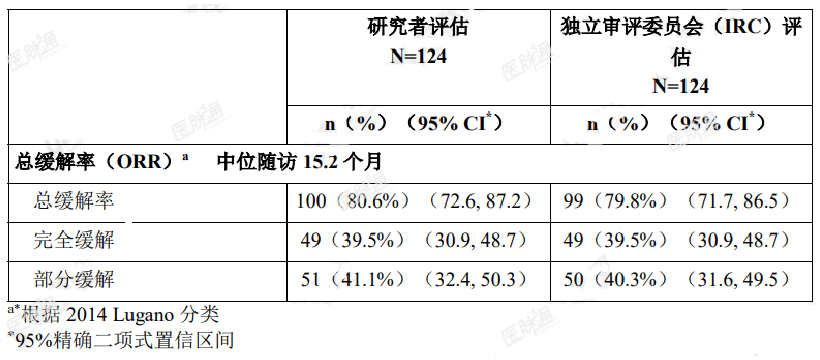
在 124 例既往接受过治疗的 MCL 患者中开展了一项开放、多中心、单臂 II 期研究(ACE-LY-004),评价了本品治疗 R/RMCL 的安全性和有效性。所有患者口服本品 100 mg 每日两次,直至疾病进展或出现不能耐受的毒性。该试验未包含既往接受过 BTK 抑制剂治疗的患者。主要终点为根据 2014LuganoNHL 分类评估的总缓解率(ORR)。试验还包括另一项结果测量指标缓解持续时间(DoR)。有效性结果参见表 6。
中位年龄为 68 岁(范围:42 至 90 岁),79.8% 为男性,74.2% 为高加索人。基线时,92.8% 患者的 ECOG 体能状态评分为 0 或 1。自首次诊断至开始接受研究药物的中位时间为 46.3 个月,中位既往治疗方案数为 2(范围 1-5),包括 17.7% 既往进行干细胞移植的患者。最常见的既往治疗方案为 CHOP 化疗(51.6%)和 ARA-C 化疗(33.9%)。基线时,37.1% 的患者至少有一个病灶的长径 ≥ 5 cm,72.6% 有结外受累,50.8% 累及骨髓。43.5% 患者的 sMIPI 评分(包括年龄、ECOG 评分以及基线乳酸脱氢酶和白细胞计数)为中危,16.9% 患者的 sMIPI 评分为高危。中位剂量强度为 98.5%。
表 10. ACE-LY-004 中 MCL 患者的有效性结果
在本研究最后一位患者入组研究 54 个月,即中位随访时间为 38.1 个月时,根据研究者的评估,共有 101 名患者达到缓解,总缓解率为 81.5%(95%CI:73.5%,87.9%),其中达到完全缓解的患者为 59 名(47.6%[95%CI:38.5%,56.7%]),达到部分缓解的患者为 42 名(33.9%[95%CI:25.6%,42.9%]),中位 DOR 为 28.6(95%CI:17.5,39.1)个月。中位无进展生存期(PFS)为 22(95%CI:16.6,33.3)个月。中位总生存期(OS)为 59.2(36.5,NE)个月。
淋巴细胞增多症
开始本品治疗后,ACE-LY-004 中 31.5% 患者的淋巴细胞计数一过性增加(定义为绝对淋巴细胞计数[ALC]相对于基线增加 ≥ 50% 且基线后评估 ≥ 5 × 10)。至首次发生淋巴细胞增多症的中位时间为 1.1 周,淋巴细胞增多症的中位持续时间为 6.7 周。
基于单臂临床试验的主要缓解率结果附条件批准 MCL 适应症,确证性临床试验正在进行中。
贮藏:
不超过 30 ℃ 保存。
包装:
聚酰胺铝/聚氯乙烯冷冲压成型固体药用复合硬片 + 药用铝箔的泡罩包装。8 粒板,7 板盒。
有效期:
36 个月
执行标准:
JX20230018
进口药品注册证号:
国药准字HJ20233138
委托方企业: AstraZeneca Pty Ltd.生产企业:
AstraZeneca AB