
慢性期
本期要点:
二代TKI耐药主要由BCR::ABL1基因的新突变引起,治疗失败的标准已更新,强调了对突变的监测和应对策略的重要性。
新型治疗选项如Ponatinib、Asciminib和
二代TKI的耐药机制
治疗耐药性的最常见原因是BCR::ABL1基因的新突变,例如激酶结构域的突变或BCR::ABL1的过度表达/扩增,这些情况会破坏TKI的结合能力。约有1/3的耐药的慢性期患者是由于这些突变引起的。此外,耐药性还可能通过非BCR::ABL1机制发生。在接受伊马替尼治疗的TKI耐药患者中,ASXL1的遗传畸变显著升高,这引发了对BCR::ABL1阳性白血病克隆中可能预先存在的ASXL1突变对伊马替尼临床反应影响的担忧。然而,由于样本量有限,需要进一步研究来验证这一相关性。
在诊断时,发生突变较为罕见,但患者可能因不依从治疗而出现突变,进而导致对TKI的耐药,或在多次序贯TKI治疗后发生突变,这些突变与缓解率降低及总生存期较差相关。突变通常涉及BCR::ABL1激酶结构域中的获得性点突变。
TKI的序贯治疗会增加复合突变的风险,76%的病例中发现了两对突变,而同一个BCR::ABL1等位基因中出现三个(10.6%)或四个(1.5%)突变的情况也并不少见。不幸的是,即使是三代TKI,通常也对这些突变不敏感[1]。
治疗失败的标准
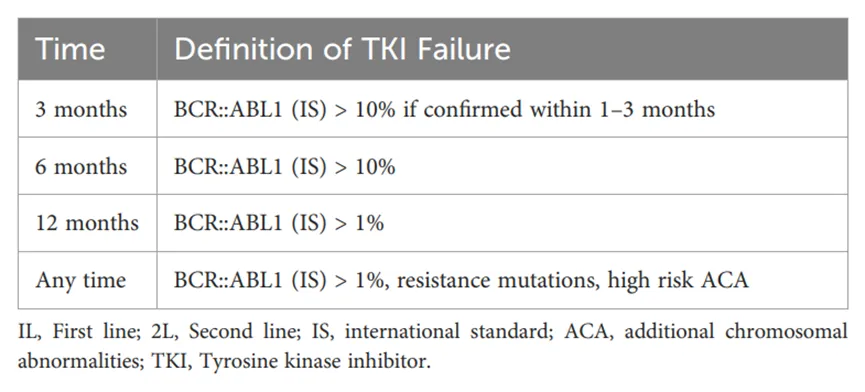
治疗失败可分为真正的耐药和不耐受,该篇文章重点讨论了二代TKI的真正耐药性。在CML-CP治疗过程中,国际标准(IS)建议使用实时逆转录聚合酶链反应(RT-PCR)测定BCR::ABL转录水平,以评估在不同时间点(如3、6、12个月)是否达到目标分子学应答。
2013年,欧洲白血病网络(ELN)对一线和二线TKI治疗失败的标准进行了定义,二线治疗失败的指导相对不严格。然而,在2020年,ELN更新标准,将存在突变且在12个月时未达到BCR::ABL1IS ≤ 1%或完全细胞学缓解(CCyR)视为治疗失败,这一标准适用于所有接受二线TKI治疗的患者。ELN 2020标准的详细信息见表1。
表1
一线二代TKI耐药后的治疗选择和结局
尽管伊马替尼被认为是最安全的选择,但对于几种BCR::ABL突变(除守门人突变T315I外),其抑制效果并不理想。到五年时,接受二代TKI治疗的患者中,实现MR4.5(BCR::ABL1IS <0.0032%)的比例为30-55%,而接受伊马替尼治疗的患者中约为30%。尽管二代和三代TKI在实现更快和更深入的反应方面优于伊马替尼,目前尚无数据证明它们具有更高的治愈率。
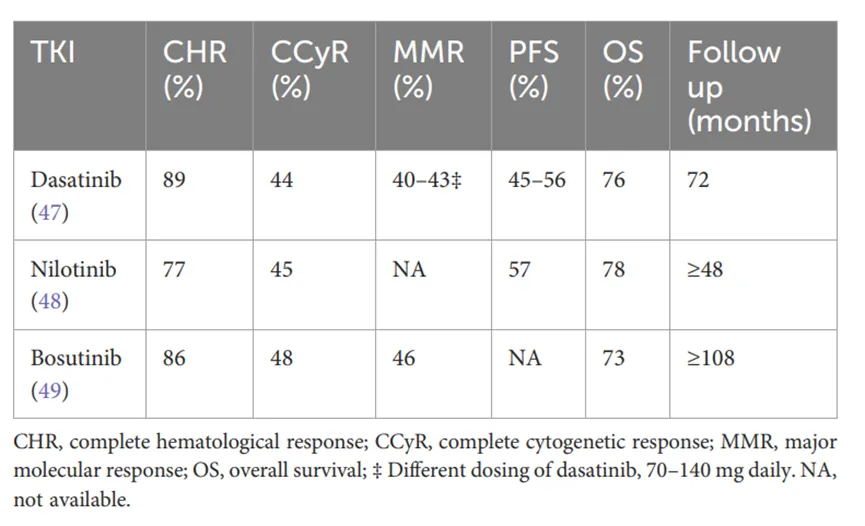
大约50%的CML-CP患者在接受伊马替尼治疗五年内需要更换治疗,而接受一线二代TKI治疗的患者中这一比例为30-40%。其中,约15%-25%的治疗更换是由于与T315I突变相关的真正耐药性,而只有5-7%是由于不耐受。在五年时,尼罗替尼(ENESTend)、
表2
治疗选择
Ponatinib
Ponatinib是一种三代TKI,已获批准用于治疗有T315I突变的CML慢性期患者,以及对至少两种TKI耐药或不耐受的患者。在关键的PACE试验的五年随访中,研究纳入了经历过多线治疗的患者,包括对达沙替尼或
在267例可评估的CML慢性期患者中,经过56.8个月的中位随访和32.1个月的中位治疗时间,144例患者(54%)达到了完全细胞遗传学缓解(CCyR),108例患者(40%)达到了主要分子反应(MMR),而64例患者(24%)达到了MR4.5。在12个月时达到主要细胞遗传学反应(MCyR)和在任何时间达到MMR的患者中,分别有82%和59%的患者在5年时维持了应答。对于获得缓解的患者,中位时间到达MCyR、完全细胞遗传学反应(CCyR)和MMR分别为2.8、2.9和5.5个月。Kaplan-Meier估计的5年无进展生存期(PFS)和总生存期(OS)分别为53%和73%[2]。
Asciminib
Asciminib是一种新型BCR-ABL1抑制剂,其作用机制与现有的TKI不同。2021年10月,FDA批准Asciminib用于三线治疗或携带T315I突变的患者,突显了其在治疗中的重要性。
Asciminib的疗效最初在I期CABL001X2101试验中进行评估,试验中Asciminib被用于CML-CP或加速期(CML-AP)的单药治疗,或与尼洛替尼或达沙替尼联合进行三线治疗,亦可用于T315I突变患者的二线治疗。在150例接受单药治疗的患者中,结果显示良好的疗效,多个时间点均有显著比例的患者达到了MMR,其中19例成功达标。经过近4年的随访,115例患者的后续结果显示疗效持续,许多患者维持了MMR和分子学反应4(MR4,BCR-ABLIS≤ 0.01%)。
Omacetaxine mepesuccinate
Omacetaxine mepesuccinate是一种蛋白翻译抑制剂,虽然不靶向BCR-ABL激酶结构域,但通过下调MCL-1诱导BCR::ABL1阳性细胞凋亡。它对T315I突变有效,自2012年以来已获得FDA批准,并在美国用于治疗≥两种TKI耐药或不耐受的患者,包括T315I突变患者。
在一项研究中,纳入了76例既往接受过多线治疗的可评估CML-CP患者。患者接受皮下给药1.25 mg/m2,每天两次(BID)作为诱导治疗,给药周期为28天,最长连续给药14天,直至达到血液学缓解。随后,维持治疗同样为1.25 mg/m2,BID,每28天给药1次,最长连续7天。
研究结果显示,53例患者(70%)获得了完全血液学缓解(CHR),14例(18%)获得了MCyR,7例(9%)获得了CCyR。此外,3.9%的患者达到了部分细胞遗传学缓解(PCyR),18.4%达到了MCyR。在40例既往接受过两种TKI治疗的患者中,31例(78%)达到了CHR,10例(25%)达到了MCyR,5例(13%)达到了CCyR。而在36例既往接受过三种TKI治疗的患者中,22例(61%)达到了CHR,4例(11%)达到了MCyR,2例(6%)达到了CCyR。
在基线时有T315I突变的22例患者中,18例(82%)获得了CHR,5例(23%)获得了MCyR,3例(14%)获得了CCyR。在35例CML加速期患者中,14.3%获得了主要血液学缓解,11.3%获得了CHR,其中2.9%的患者无白血病证据[3,4]。
奥雷巴替尼
尽管CML-CP的治疗方案多种多样,但一些患者仍对现有的所有TKI产生耐药或不耐受,因此迫切需要开发新的TKI,特别是针对三线治疗和携带T315I突变的患者。
奥雷巴替尼(HQP1351)是一种前景广阔的候选药物,属于第三代口服活性BCR-ABL1 TKI,能够有效治疗CML,无论基因型如何。该药物在101例患者中进行了I期和II期试验,其中包括86例CML-CP患者和15例CML-AP患者。从诊断到开始接受奥雷巴替尼治疗的中位时间为6年。在这些患者中,63%存在T315I突变,83%曾接受过≥2线TKI治疗。
经过30个月的中位随访,CML-CP患者的CHR、CCyR和MMR率分别为97%、62%和51%。对于携带T315I突变的患者,这些比例分别为100%、84%和72%。在3年的随访中,CML-CP患者的PFS率为96.3%,而CML-AP患者为71.4%。该试验采用隔日一次的给药方案,持续28天,剂量范围为1~60 mg。在不良反应方面,任何级别的血小板减少发生率为75.2%,其中3/4级血小板减少的发生率为49.5%。最常见的非血液学不良反应包括1/2级的皮肤色素沉着和高甘油三酯血症。
小编点评
尽管CML-CP在治疗上有了显著进展,但仍有相当一部分患者在使用一线伊马替尼后出现治疗失败。根据统计,约30-50%的患者在五年内未能获得满意的治疗效果。这一现象促使我们更加关注对现有TKI进行战略性测序,以优化患者的反应,同时减少突变和耐药性的发生。
近年来,新疗法的研发逐渐聚焦于ATP竞争性BCR-ABL1抑制剂,其中Asciminib显示出了良好的临床结果,可能有助于解决一些未满足的治疗需求。此外,其他信号通路如JAK/STAT、mTOR以及免疫信号通路也被认为是CML治疗中有潜力的靶点。
然而,一些患者可能无法耐受二代TKI(如达沙替尼、尼洛替尼)或Ponatinib,或不适合接受异基因造血干细胞移植,同时也可能不符合参与临床试验的条件。在这种背景下,干扰素α作为一种传统的治疗选择,仍然可能为这些患者提供可行的治疗方案。