
弥漫性大B细胞淋巴瘤(DLBCL)是最常见的淋巴瘤类型之一,约占

为了突破当前R/R DLBCL面临的困境,靶向CD19的人源化单克隆抗体Tafasitamab应运而生。2022年7月21日,国内外大咖齐聚一堂,哈尔滨
主席致辞
会议伊始,大会主席马军教授、吴德沛教授、朱军教授和赵维莅教授在开场致辞中表示,

Gilles Salles教授:Tafasitamab在R/R DLBCL中的应用
在朱军教授的主持下,美国纽约纪念斯隆-凯特琳癌症中心淋巴瘤中心Gilles Salles教授从Tafasitamab结构机制、临床研究、病例分享、未来探索方向等方面,讲解了Tafasitamab在R/R DLBCL中的应用。

结构机制创新,Tafasitamab与
Tafasitamab是一种靶向CD19的新型人源化Fc增强单克隆抗体,其Fc结构域进行了修饰(包含2个氨基酸取代S239D和I332E),通过提高对效应细胞上激活型FcγRIIIa的亲和力,显著增强抗体依赖性细胞介导的细胞毒性作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),从而改善肿瘤细胞杀伤的关键机制(图1)。在临床前模型研究中,Tafasitamab已被证实通过结合CD19可诱导肿瘤细胞直接凋亡。
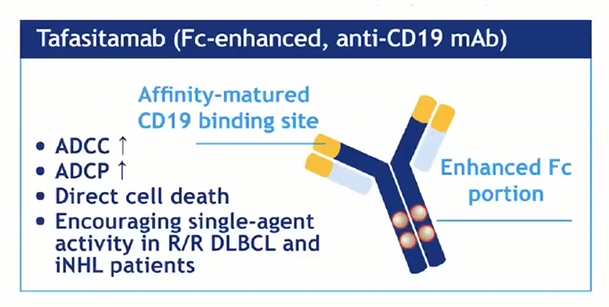
图1 Tafasitamab结构示意图
L-MIND是一项开放标签、多中心、单臂II期研究,评估了Tafasitamab联合来那度胺(以下简称:Tafa+Len)治疗既往已接受至少一种但不超过3种疗法(至少接受一种抗CD20靶向治疗)、不适合接受大剂量化疗和自体
受试者接受Tafasitamab(12 mg/kg静脉注射,前三个周期每周一次,在第一周期的第4天给予负荷剂量,随后每两周一次)和来那度胺(25 mg/d口服,第1-21天/周期),持续12个周期(每个周期28天),随后接受Tafasitamab单药巩固治疗直到疾病进展。主要终点是客观缓解率(ORR)。
中位随访13.2个月时的第一次分析结果显示,Tafa+Len治疗的ORR为60%(95%CI 48-71),其中CR率为42.5%、部分缓解(PR)率为17.5%(图2)。中位缓解持续时间(DOR)为21.7个月(95%CI 21.7-NR,图3)。

图2 CR、PR
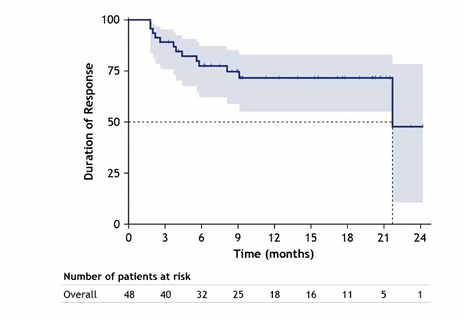
图3 DOR
安全性方面,Tafa+Len治疗阶段,最常见3级或更严重的不良事件是中性粒细胞减少症(48%)、
随访超过35个月时结果显示,CR患者中80%仍然存活且未复发,PR患者仍能继续保持缓解。中位无进展生存期(PFS)为11.6个月,中位OS为33.5个月,中位DOR长达43.9个月(图4)。

图4 随访35个月时研究终点
此外,研究还通过临床特征对30个月PFS率进行了分析。结果显示,相较于IPI评分较高的患者,IPI评分较低的患者30个月PFS率更高(59.5% vs 20.8%);只接受过一线治疗的患者比接受过大于等于二线治疗的患者获益更多(47.8% vs 34.3%,图5)。
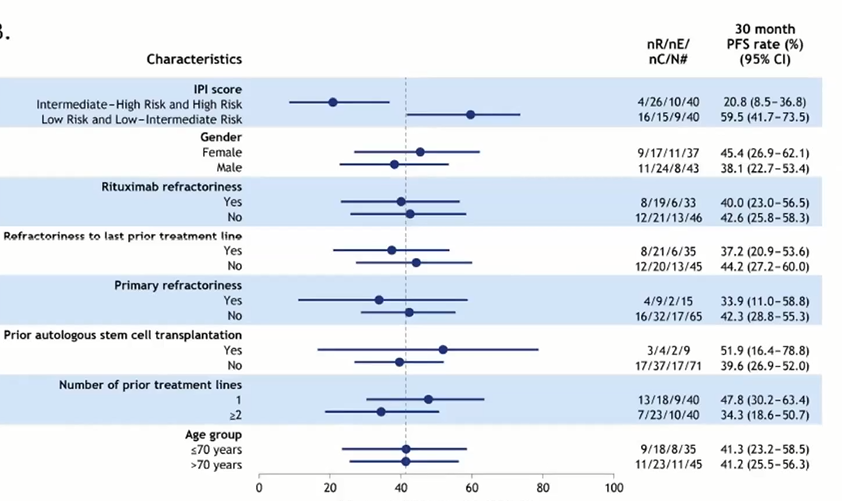
图5 根据临床特征分析的30个月PFS率
Tafa+Len疗效与安全性进一步得到证实
RE-MIND是一项回顾性观察研究,该研究收集了真实世界中接受来那度胺单药治疗的R/R DLBCL患者的数据,并与L-MIND研究数据进行了比较[4]。研究结果显示,Tafa+Len最佳ORR显著优于来那度胺单药治疗(67.1% vs 34.2%;OR=3.89;95% CI 1.90–8.14;P<0.0001,图6)。并且与来那度胺单药治疗相比,Tafa+Len也获得了更高的CR率(39.5% vs 13.2%),更长的中位DOR(20.5 vs 6.6个月)。

图6 最佳ORR
此外,RE-MIND2研究将L-MIND数据,与接受美国国立综合癌症网络(NCCN)/欧洲医学肿瘤学会(ESMO)推荐的R/R DLBCL全身系统性治疗(BR、R-GemOx、R2、CAR-T、Pola-BR等)的患者数据进行了对比[5]。
研究结果显示,Tafa+Len与全身系统治疗(34.1 vs 11.6个月;HR:0.55;P=0.0068),BR(31.6 vs 9.9个月;HR:0.42;P<0.0001)和R-GemOx(31.6 vs 11.0个月;HR:0.47;P=0.0003)相比,OS显著延长。
在三项匹配队列比较中,Tafa+Len队列的ORR为66.7%(95%CI 54.8-77.1;P=0.181),中位DOR为26.1个月(95% CI 13.9-NR),而全身系统治疗、BR和R-GemOx队列中观察到的ORR分别为48.7%、54.7%、45.9%,中位DOR分别为6.6、9.2和9.5个月。
BR:
研究又进一步将Tafa+Len与Pola-BR、R2以及CAR-T进行分析比较。结果证明Tafa+Len的OS优于Pola-BR、R2;而对比CAR-T疗法,Tafa+Len方案具有相似的OS获益,但具有更长的DOR(图7)。
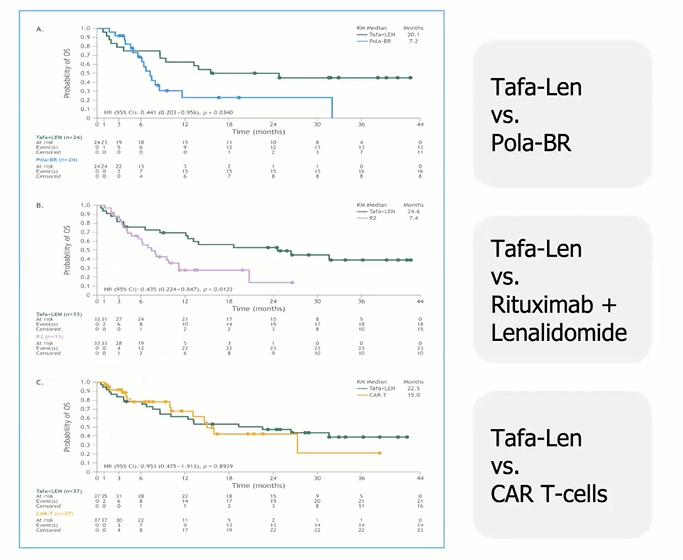
图7 OS
实践助力临床研究落地,Tafasitamab在NHL中的研究持续进行中
实践出真知,Gilles Salles教授列举了两个实际临床应用的病例:
病例1,男性,90岁,2019年确诊DLBCL,给予R-mini-CHOP6个周期后,获得CR,2020年6月复发。
考虑患者年龄较大,予以Tafa+Len治疗,第12天
病例2,女性,70岁,2018年确诊DLBCL,伴随BCL2和MYC双表达,FISH检测BCL2、BCL6异位。R-CHOP治疗复发后,进行挽救治疗,2019年接受CAR-T治疗,1年后获得CR。
2020年10月再次复发,予以2周期Tafa+Len后,患者获得CR,没有明显不良反应。2021年10月患者仍处于CR状态,后因个人原因,在治疗12个周期后停药。由此可见,患者CAR-T治疗失败后,仍然可以使用Tafa+Len治疗。
目前美国食品药品监督管理局(FDA)以及欧洲药品管理局(EMA)已批准了Tafa+Len用于不适合自体造血干细胞移植条件的R/R DLBCL,并且该联合治疗方案在NCCN指南中也获得优选推荐。
此外,Tafasitamab也在尝试将治疗线数前移,或与其他化疗药物联用,如Tafasitamab联合R-CHOP或R2-CHOP在一线治疗DLBCL中的应用的First-MIND研究,Tafasitamab联合苯达莫司汀 vs BR的B-MIND研究,Tafasitamab联合R2在
最后,Gilles Salles教授总结道,CD19在B细胞谱系起源的恶性肿瘤中表达水平较高,并且不在B细胞谱系之外的细胞表达,因此在一定程度上降低了脱靶毒性。Tafasitamab作为靶向CD19的新型人源化Fc增强单克隆抗体。L-MIND研究中Tafa+Len治疗不适合自体造血干细胞移植的R/R DLBCL患者,随访超过35个月,ORR达到57.5%,CR达到40.0%,中位DOR长达43.9个月,总体不良反应可控,安全性良好,证明了Tafa+Len的有效性和安全性。R-MIND2研究数据进一步证明与现有疗法相比,Tafa+Len获得更多生存获益。总之,Tafa+Len是一项疗效卓越耐受性良好、颇具前景的治疗方案。
专家讨论
在Gilles Salles教授的精彩报告后,与会专家展开了热烈的讨论。
朱军教授表示,CD19相较于CD20表达更广泛,从理论上来讲,抗CD19单抗Tafasitamab上市后的应用范围至少不亚于抗CD20单抗。黄海雯教授表示,如果既往没有接受靶向CD19的治疗,如CAR-T,在应用Tafasitamab时,患者不需要检测CD19。
关于Tafasitamab在临床实际中的应用,如对患者住院的影响,Gilles Salles教授表示,虽然目前还没有发布完整的数据,但是在L-MIND研究过程中,输注不良反应的发生率较低且易于管理,患者耐受性较好,患者住院的时间相对较短。
针对Tafasitamab未来上市后的受众人群与应用潜力,邱录贵教授表示,主要是不适合自体造血干细胞移植、处于二线治疗阶段的R/R DLBCL患者,目前该类患者常用治疗方案为R-Gemox方案和临床试验,相信Tafasitamab的上市,会更加丰富R/R DLBCL患者治疗选择,惠及更多人群。黄慧强教授表示,Tafa+Len的中位DOR 21.7个月令人印象深刻,这可能与Tafasitamab FC结构域的改造以及Tafa+Len持续用药有关,并表示未来很愿意将Tafa+Len推荐给合适的病人,尤其是不适合移植的老年R/RDLBCL患者。金洁教授表示,Tafa+Len疗效显著,不良反应较轻,与CAR-T相比,无须定制化制备,使用更便捷,未来应用潜力巨大。
对于未来Tafasitamab联合用药的研发方向,张曦教授表示,表观遗传药物在调节免疫反应方面有不同的方法和路径,可以激活更多的免疫细胞,从而达到更好的免疫效果。Tafa+Len的研究结果很振奋人心,如果在此基础上联用表观遗传药物,可能会发挥更好的作用,这也是值得研究的方向之一。
总结
在热烈的讨论后,本次会议落下帷幕。朱军教授总结道,Tafasitamab一系列亮眼的研究结果提升了中国临床医生未来应用Tafasitamab的信心。结合当前CD19 CAR-T在中国应用情况,抗CD19单抗Tafa+Len在一线治疗失败、不适合接受大剂量化疗及自体造血干细胞移植的DLBCL患者中应用空间很大。虽然目前仍有诸多问题需要回答与解决,如CD19的表达量与疗效的关系,适应症的扩展,联合应用的方式等,但是相信在中外医生共同努力下,Tafasitamab一定可以为中国患者提供可及、可用、更优的治疗新方案,惠及更多患者。