
研究方法
该研究为开放标签、前瞻性II期临床试验,旨在评估48周治疗期间Pegcetacoplan的安全性、耐受性、初步疗效及药代动力学。研究计划纳入24例患者,分为两个独立分析的队列:CAD队列与wAIHA队列各12例。
纳入标准包括:年龄≥18岁;体重<125 kg;确诊为CAD(C3)或wAIHA(IgG);血红蛋白(Hb)<11 g/dL等。两个队列患者按1:1比例随机接受每天一次皮下注射270 mg或360 mg Pegcetacoplan治疗,持续48周。
安全性评估重点关注治疗期间不良事件(TEAE)及特殊关注不良事件(AESI)的发生率与严重程度。疗效指标包括血红蛋白水平、乳酸脱氢酶、网织红细胞绝对值、结合珠蛋白、
研究结果
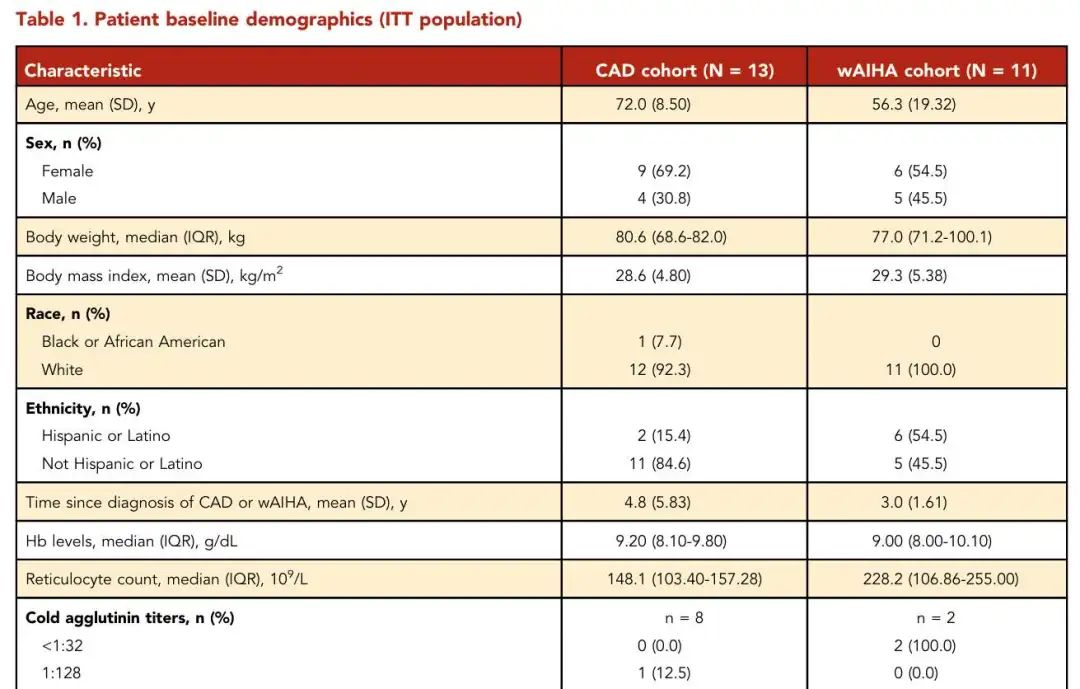
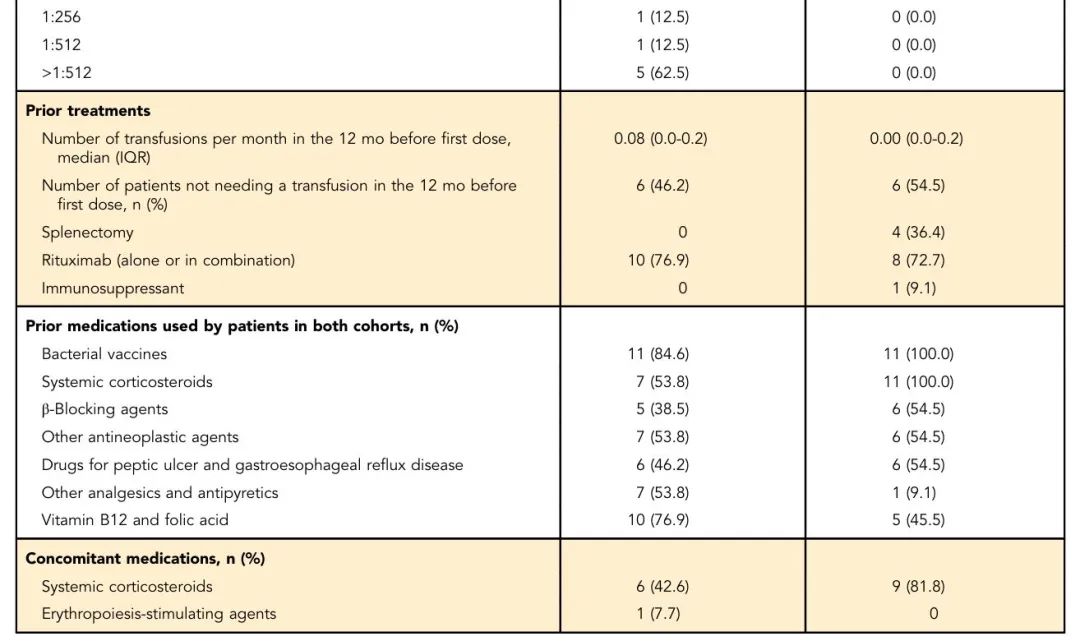
在30例接受筛查的患者中,13例CAD患者与11例wAIHA患者符合入组标准(表1)。CAD队列中7例和6例患者分别接受270 mg/d和360 mg/d治疗,wAIHA队列中5例和6例患者分别接受270 mg/d和360 mg/d治疗。两组平均治疗天数分别为283.2天(SD=107.80)和236.0天(SD=140.56),总体治疗依从性良好。
表1
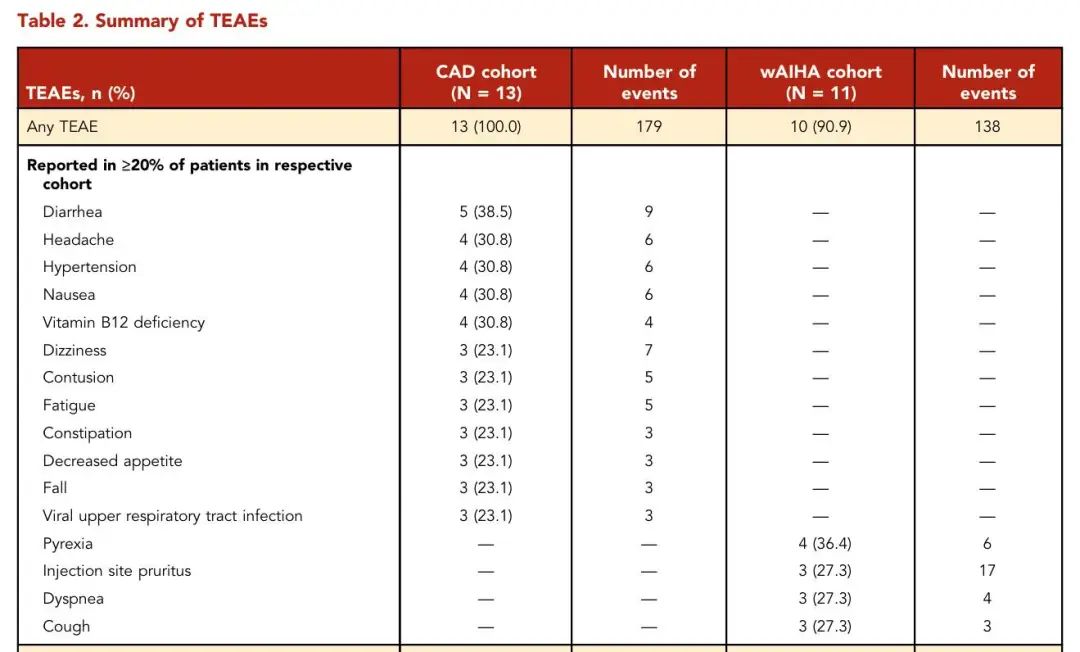
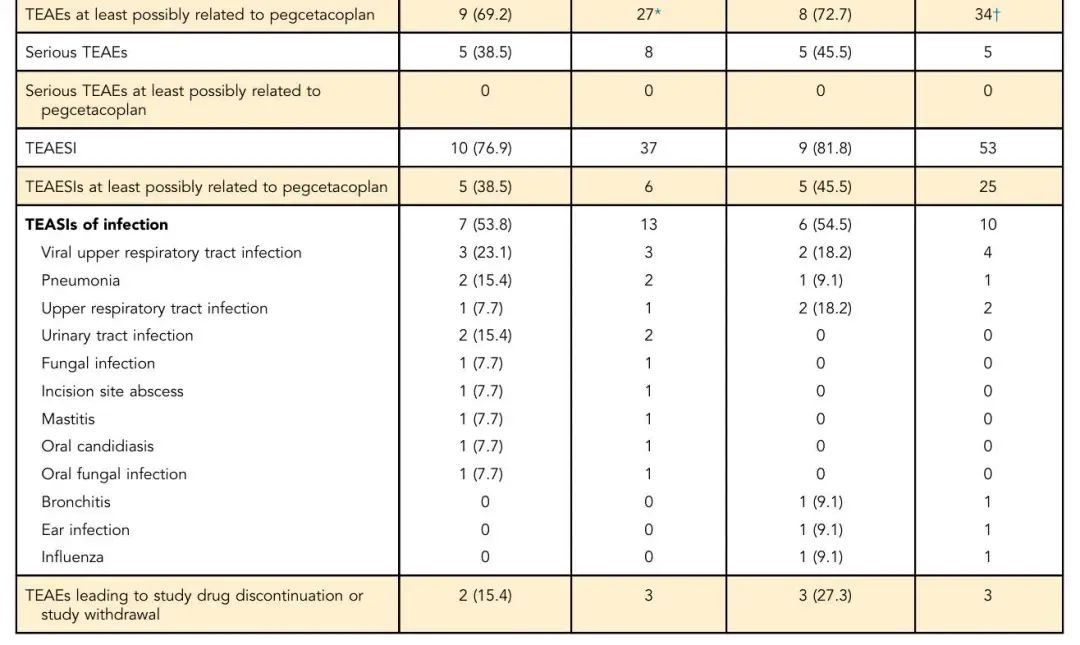
CAD队列全部13例患者(100%)及wAIHA队列10/11例患者(90.9%)出现至少1次TEAE。最常见不良事件包括
表2
CAD队列:中位血红蛋白水平在治疗前4周显著上升并维持稳定。第8周时,中位CFB为2.4 g/dL(270 mg/d组1.7 g/dL,360 mg/d组2.4 g/dL),至第48周维持2.4 g/dL(270 mg/d组1.8 g/dL,360 mg/d组2.7 g/dL)。
wAIHA队列:中位血红蛋白水平持续升高至第8周(中位CFB 2.7 g/dL;270 mg/d组1.5 g/dL,360 mg/d组2.7 g/dL),此后趋于平稳。第48周时,中位CFB为1.7 g/dL(270 mg/d组0.2 g/dL,360 mg/d组1.7 g/dL)。
研究结论
该研究存在开放标签设计、缺乏对照组及样本量有限等局限性,这些在罕见病临床试验中较为常见。研究结果表明,皮下注射Pegcetacoplan总体耐受性良好,并显示出治疗CAD和wAIHA的潜在临床价值。基于II期研究获得的积极结果,目前已设计一项III期安慰剂对照研究(NCT05096403),旨在进一步验证该药物的疗效。