
弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)最常见的病理亚型,约占新诊断NHL的30%[1]。近20年来,虽然不断有新药问世但R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松)在DLBCL患者中一线治疗地位始终未被超越;且一线免疫化疗仅能使约60%的患者治愈,仍有30%-40%的患者会面临复发或难治,这类患者治疗通常缺乏有效治疗手段、预后差、生存期短,有大量未被满足的临床需求[2]。DLBCL存在很大的生物学异质性,基于细胞起源(COO)分类的分层治疗已无法满足临床需求。
如何突破DLBCL患者一线治疗的疗效瓶颈、走出复发或难治性DLBCL(R/R DLBCL)患者挽救治疗的困境?需要研究者们更深入的去认识DLBCL生物学特性并对DLBCL进行新分类,基于此探索更有针对性的个体化治疗策略。近几年关于DLBCL新的基因分类的相关重磅研究成果接连在权威杂志《The New England Journal of Medicine》、《Nature Medicine》及《Blood》上发表。本文对DLBCL新的基因分类相关研究进展进行梳理,旨在与读者共同学习。
DLBCL的遗传学分型
Schmitz R等人[3]选取了574例DLBCL患者的新鲜冰冻活检标本,采用外显子组和转录组测序、基于阵列的DNA拷贝数分析和372个基因的深度扩增重测序来识别具有复发性突变的基因。
根据研究结果,提出了DLBCL新的基因分型:MCD亚型(N=71,主要为MYD88L265P和CD79B共突变);BN2亚型(N=98,主要为BCL6融合和NOTCH2突变);N1亚型(N=19,主要为NOTCH1突变);EZB亚型(N=69,主要为EZH2突变和BCL2易位)。其中MCD和N1亚型主要为起源于ABC的病例、EZB亚型主要为起源于GCB的病例,BN2亚型在起源于ABC、GCB和不能分类的病例中均占有一定比例。该研究显示,能将46.6%的DLBCL患者根据MCD、BN2、N1和EZB亚型的基因表达预测分类。
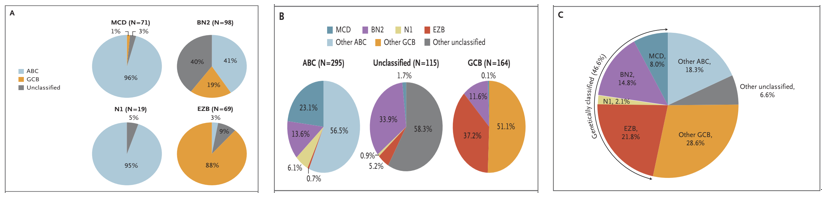
该研究进一步分析了DLBCL新的基因分类亚型与基于初治接受免疫化疗(R-CHOP或CHOP样方案化疗;N=240)患者的预后关系,结果显示新的基因分型能很好的预测这类患者的预后:四种亚型在无进展生存(PFS)和总生存(OS)方面存在显著差异,BN2和EZB亚型的预后优于MCD和N1亚型,其中MCD、BN2、N1及EZB亚型的预测5年OS率分别为26%、36%、65%和68%;而在ABC来源的DLBCL中MCD亚型的PFS和OS明显低于BN2亚型,MCD或N1亚型的PFS和OS明显低于其他ABC来源的患者,在GCB来源的DLBCL中EZB亚型的OS明显低于其他GCB来源的患者。多变量分析结果显示,新的基因亚型分类是影响患者生存的独立影响因素,不同基因亚型间的IPI评分差异不显著。
该研究显示DLBCL的不同基因亚型具有明显的基因型、表观遗传学和临床特征的差异,为DLBCL的精准治疗策略提供了潜在的病理学依据。
DLBCL的分子亚型与独特的致病机制和临床预后结果相关
Chapuy B等人[4] 对304例DLBCL进行了全面的遗传分析,确定了低频变化、捕获的复发突变、体细胞拷贝数变化和结构变异相关数据。
该研究在可用结果数据的患者中定义了五个不同基因亚型:C1型(N=56,主要为BCL10、TNFAIP3、UBE2A、CD70突变和BCL6易位,多为ABC来源的DLBCL病例);C2型(N=64,存在TP53双等位基因失活,影响染色体稳定性和细胞周期,与ABC/GCB来源无关);C3型(N=55,主要为BCL2、CREBBP2、EZH2、KMT2D、TNFRSF14突变,主要为GCB来源的DLBCL病例);C4型(N=51,主要为SGK1、HIST1H1E、NFKBIE、BRAF和CD83突变,多为GCB来源的病例);C5型(N=64,主要为CD79B、MYD88L265P、ETV6、PIM1和TBL1XR1突变,多为ABC来源的DLBCL病例,原发中枢神经系统及睾丸的DLBCL患者在此亚型中常见);C0型(N=12,缺乏明确的遗传驱动因素)。
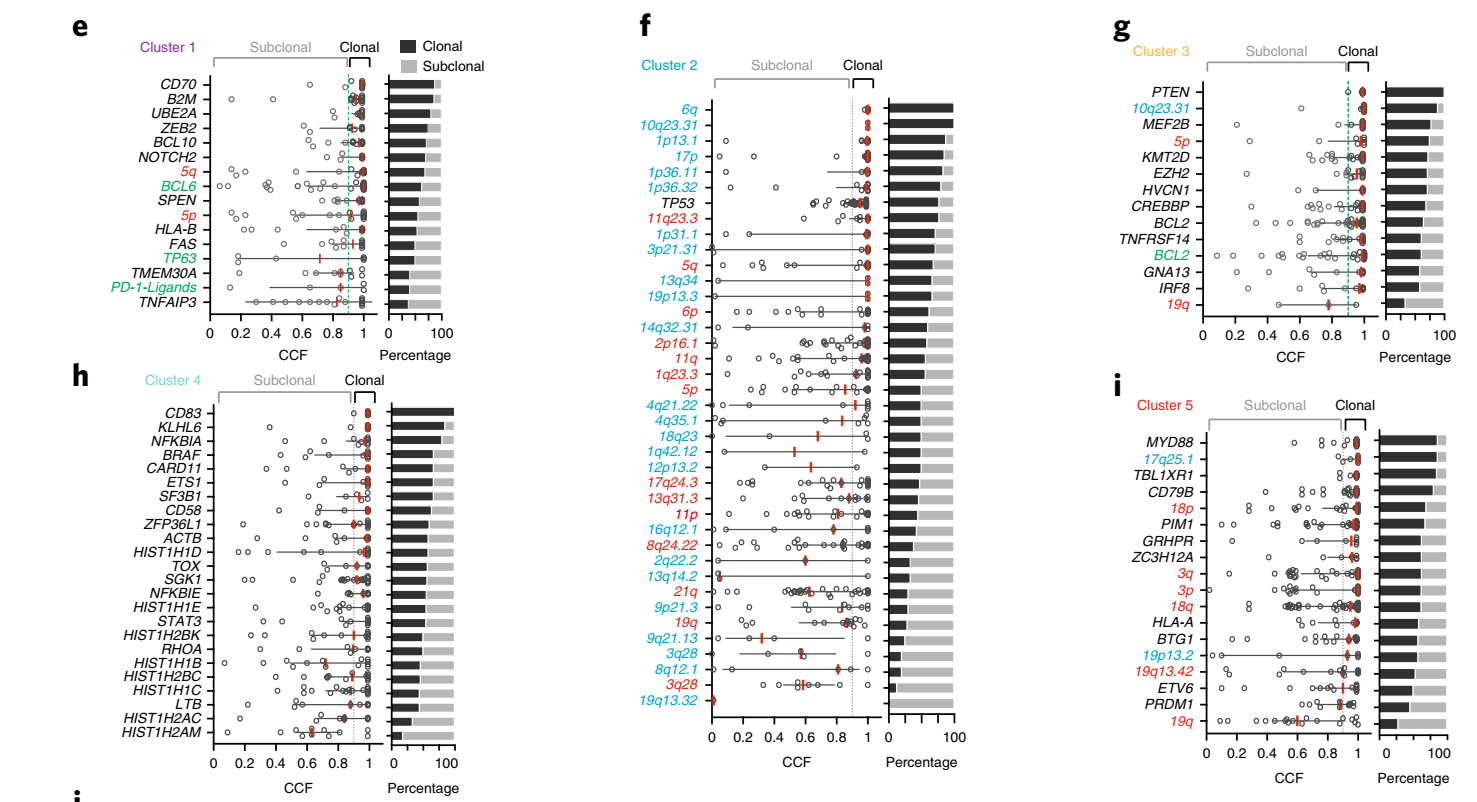
该研究进一步分析了DLBCL新的基因分类亚型与患者预后的关系,结果显示:总体而言,C0、C1和C4亚型患者的预后较好,而C3和C5亚型患者的预后较差;其中在ABC来源的DLBCL中C1亚型患者的预后明显优于C5亚型,而GCB来源的DLBCL中C4亚型患者的预后优于C3亚型。
研究者们进一步将IPI和新的遗传分型结合构建模型,以IPI低危组和预后良好的遗传亚型(C0、C1及C4)为参考进行分析。结果显示:在IPI低危组患者中C5亚型与具有良好遗传特征的亚型患者相比、危险比(HR)为2.01;在具有良好遗传特征亚型的患者,IPI高危组与低危组患者相比、HR为3.44;而C5亚型和IPI高危组的患者与参考组相比、HR为6.91(3.44×2.01)。提示基于遗传学特征的新的基因亚型分类是影响患者预后的独立影响因素。
基于遗传学特征的新的分类亚型,为DLBCL发病机理提供了新的见解;并且能很好的预测患者的预后,为临床精准治疗提供了依据。
DLBCL靶向测序、分子亚型及与预后
Stuart E等人[5]通过对293个基因的靶向测序分析了基于人群队列的928例DLBCL患者的基因突变特征,并进行分组。
该研究结果,将患者分为五个分子亚型:MYD88亚型(N=152,以MYD88L265P、PIM1、CD79B的突变为主,以ABC来源病例为主,且大多数原发中枢神经系统、睾丸和乳腺的DLBCL患者存在于此亚型中);BCL2亚型(N=176,以EZH2、BCL2、CREBBP、TNFRSF14、KMT2D和MEF2B的突变为主,以GCB来源为主,也有部分高级别淋巴瘤病例,且滤泡淋巴瘤转化而来的DLBCL患者多存在于此亚型中);SOCS1/SGK1亚型(主要包括SOCS1、CD83、SGK1、NFKBIA、HIST1H1E和STAT3突变,以GCB来源病例为主,且大多数原发纵隔DLBCL患者存在于此亚型中);TET2/SGK1亚型(N=98,主要包括TET2、SGK1、KLHL6、ZFP36L1、BRAF、MAP2K1和KRAS突变,以GCB来源病例为主);NOTCH2亚型(N=143,主要包括NOTCH2、BCL10、TNFAIP3、CCND3、SPEN、TMEM30A FAS和CD70突变,以ABC、GCB和不能分类来源的病例共同组成,与边缘区淋巴瘤具有相似的生物学特性)以及未分类亚型(NEC)。
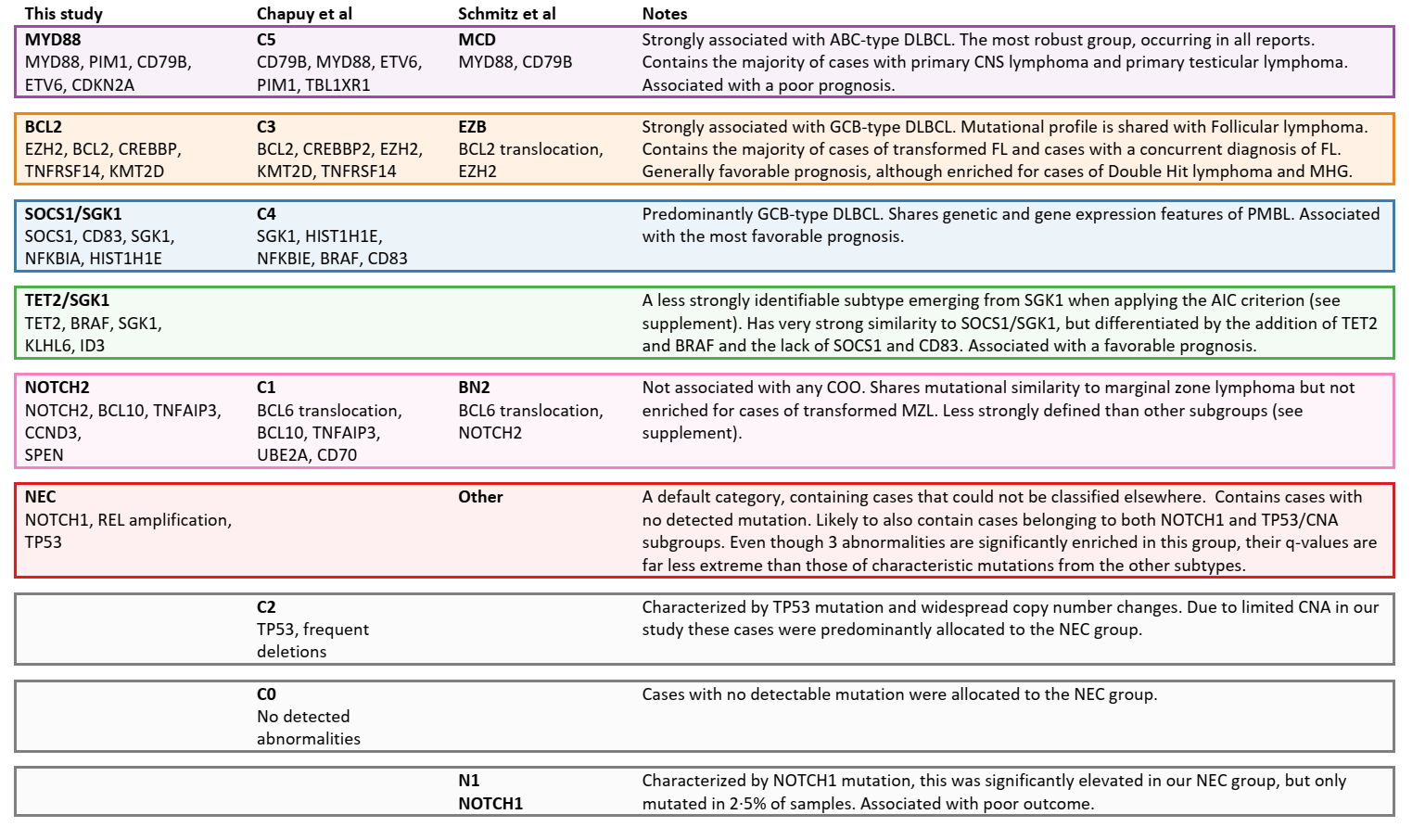
该研究分析了不同分子亚型与患者预后的关系,结果显示:总体而言,MYD88亚型预后最差,5年OS率为42%;BCL2、SOCS1/SGK1和TET2/SGK1亚型预后良好,5年OS率分别为64.9%、62.5%、60.1%;而NOTCH2和NEC亚型的预后介于二者之间,5年OS率分别为48.1%、53.6%;而基于IPI调整后的各分子亚型的HR也证实了上述结果。
MYC重排在BCL2亚型中最常见,且与该类患者接受R-CHOP治疗的预后相关、存在/不存在MYC重排患者接受R-CHOP治疗的5年OS率分别为50% vs 71%;另外,双打击淋巴瘤和高级别淋巴瘤也多见于该亚型,二者接受R-CHOP治疗的5年OS率分别为43.8%和44.4%。在NEC亚型中尽管无明确的遗传学特征,但NOTCH1突变与不良预后相关、伴NOTCH1突变的NEC亚型患者的5年OS率仅为39%。SOCS1/SGK1亚型与原发性纵隔B细胞淋巴瘤生物学重叠,预后良好。TP53突变对患者预后的影响因基因分组的亚型而异,在MYD88和BCL2亚型中与预后不良相关、在NOTCH2和SOCS1/SGK1亚型中对预后无影响、而在TET2/SGK1亚型中TP53突变很罕见。
该项研究为真实世界中大规模的研究,证实了DLBCL不同分子亚型的存在,并针对不同亚型对患者预后的影响提出了基于发病机理的见解;另外,该研究进一步完善了DLBCL的分子分型并深入探讨了不同分子亚型与临床因素相互作用对患者预后的影响,为未来DLBCL实现基于分子亚型的精准治疗提供了很好的基础。
小结
近年来基于DLBCL遗传学特征的新的基因分类研究逐渐深入和成熟,已经成功叩开了DLBCL精准诊疗的大门。但是如何将这些新的基因分析有效的应用于临床、并能与层出不穷的新药及新的治疗手段密切结合,实现DLBCL个体化的精准治疗、提高治愈率,尚需要更加系统的基础及临床研究。