031186508999
Xyb@xuekang.com

2020年9月1日,美国食品药物监督管理局(FDA)批准了阿扎胞苷片剂用于急性髓系白血病患者的维持治疗,这些患者在强化诱导化疗后获得首次完全缓解(CR)或完全缓解伴血液学计数未完全恢复(CRi),但不能完成强化治疗。该批准基于QUAZAR研究的疗效结果。
QUAZAR研究(NCT01757535)是一项多中心、随机、双盲、安慰剂对照试验。通过强化诱导化疗获得CR或CRi,接受或不接受后续巩固治疗的患者(n=472),按1:1的比例随机分配,每28天为一个周期,第1-14天接受口服阿扎胞苷片剂 300 mg(n=238)或安慰剂(n=234)治疗。
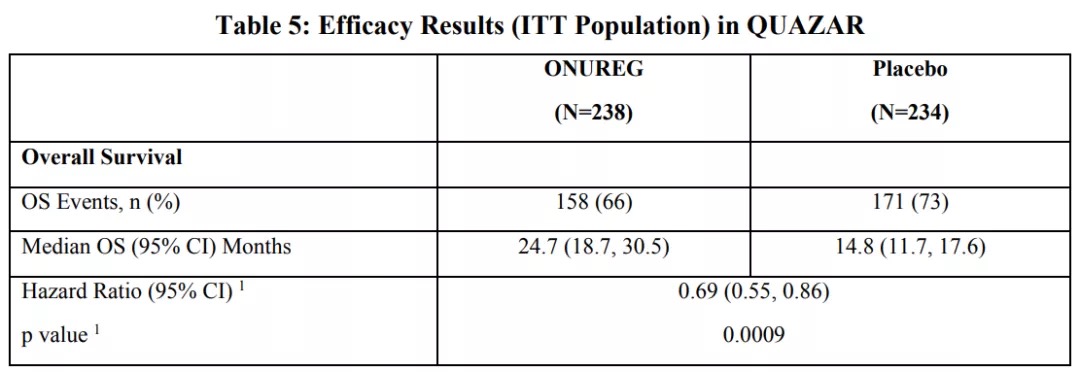
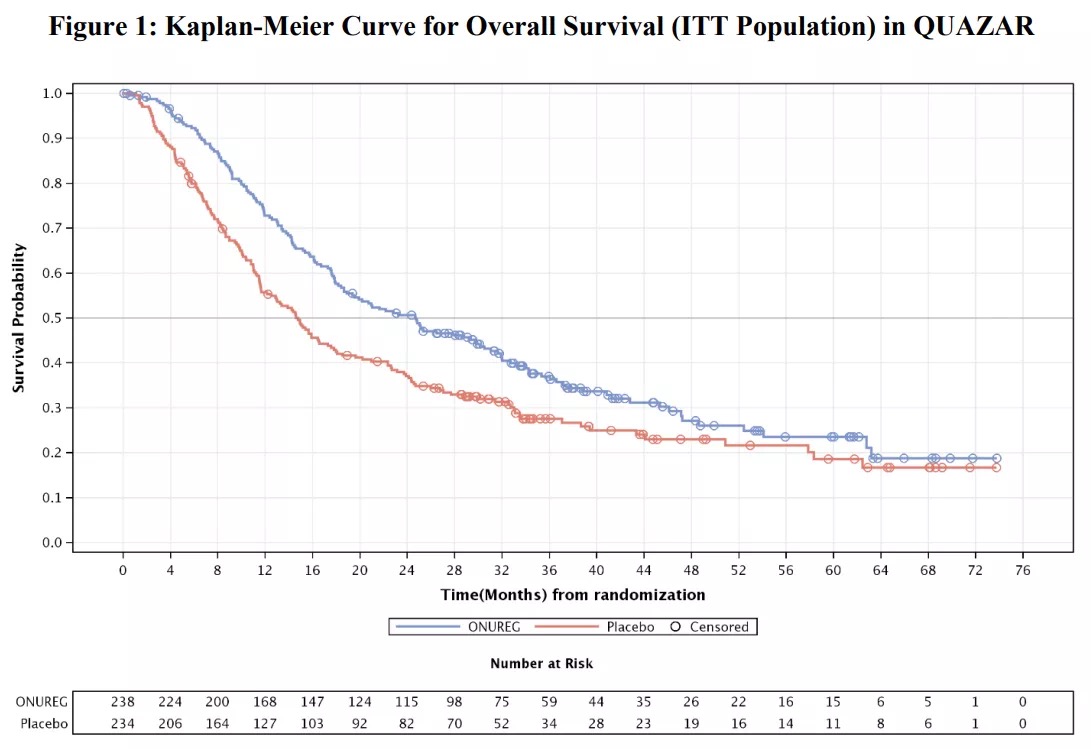
主要疗效指标是总生存期(OS)。阿扎胞苷组的中位OS为24.7个月(95%CI:18.7-30.5),安慰剂组为14.8个月(95%CI:11.7-17.6)(HR 0.69;95%CI:0.55-0.86;p=0.0009)。亚组分析结果显示,CR或CRi患者的OS获益一致。
在阿扎胞苷治疗组中,≥10%的患者出现的不良反应包括恶心、呕吐、腹泻、疲劳/乏力、便秘、肺炎、腹痛、关节痛、食欲下降、发热性中性粒细胞减少、头晕和四肢疼痛。
阿扎胞苷片剂的推荐剂量:每28天为一个周期,第1-14天伴/不伴食物口服300 mg,直到疾病进展或出现不可接受的毒性。