
骨髓增生异常综合征(MDS),曾经被称为“冒烟型白血病"/ "白血病前期", 是一类髓系造血系统的恶性肿瘤,主要临床表现为外周血细胞减少:贫血、白细胞减少和血小板减少,约有30%的患者会最终进展为急性白血病。
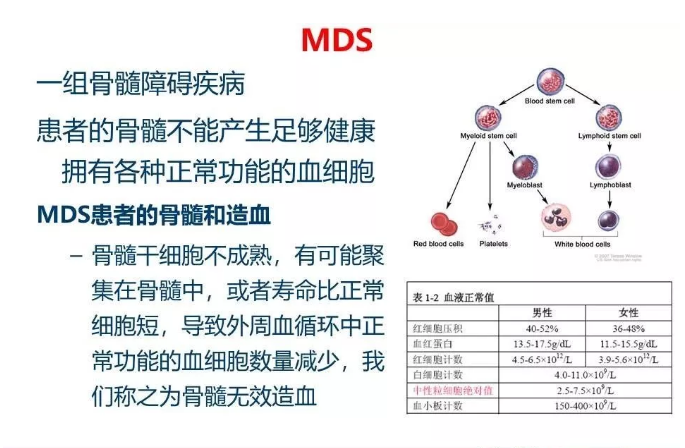
一直以来,MDS被认为是一种老年性疾病,可能的病因是外界不利环境对人类基因的持续打击,累积到一定程度无法修复DNA突变,最终导致恶性克隆的发生,流行病也证实,随着年龄的增长发病率逐年升高。
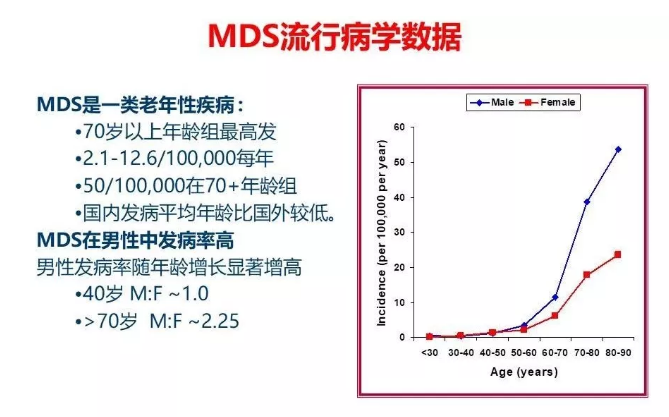
然而,儿童MDS仍不可忽视,并且与成人MDS存在明显差异。
新近<BLOOD>杂志How I Treat 发表来自意大利Pavia大学儿童血液和肿瘤中心Franco Locatelli 教授的文章:How I treat myelodysplastic syndromes of childhood。
儿童MDS与成人MDS存在明显差异
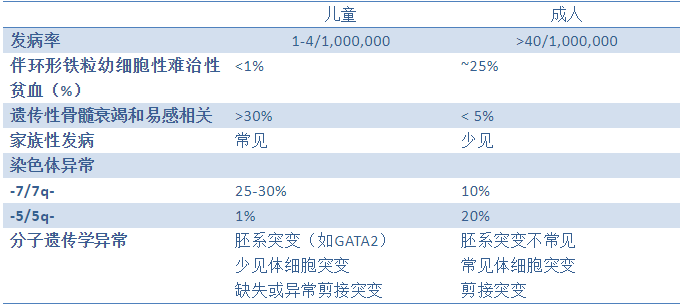
儿童MDS相对恶性程度更高,良性染色体异常(-5/5q-)少见而不良染色体(-7/7q-)异常更多见,提示预后更差。
Franco Locatelli 教授提供4个典型病例分析。
CASE 1
8岁男孩
症状:双下肢反复瘀点瘀斑
实验室检查:
中性粒细胞 1.3 × 109/L, 血红蛋白 11.1 g/dL, 血小板 34 × 109/L
骨髓检查:粒系和巨核系发育异常伴增生低下,没有检测到原始细胞比例增多,但可见红系细胞的异常定位。没有异常家族史,染色体检测正常。
诊断:儿童难治性血细胞减少(RCC)
等待和观察3月后复查,病情持续进展,中性粒细胞<1 × 109/L,血小板需要成分输血维持。
治疗方案:
亲缘中未找到全相合供者,启动非亲缘全相合基因造血干细胞移植。
预处理方案包括噻替哌和氟达拉滨,采用抗胸腺免疫球蛋白(ATG)、环孢素A、短疗程甲氨蝶呤控制排斥反应(GVHD)。随访至移植后27个月,患者历经I度皮肤型GVHD, 造血和免疫系统基本恢复正常。
分析:
➤在儿童期,难治性血细胞减少(RCC)、获得性再生障碍性贫血(AA)和遗传性骨髓衰竭(IBMFS)是常见的造血系统疾病;
➤RCC是儿童MDS的一种,男女发病率无差异,好发年龄7-8岁,相比较贫血,更多表现为白细胞和血小板的减少;
➤RCC需要和AA鉴别,前者表现为增生低下状态合并病态造血,而后者表现为骨髓造血衰竭但细胞形态正常;
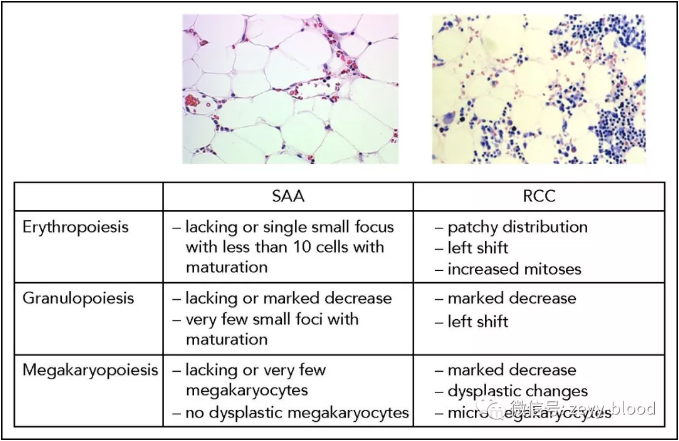
➤完整的诊断需要结合家族病史,染色体断裂检查,细胞周期分析,突变分析,以及FA基因和端粒长度测定有助于提升诊断率;
➤RCC7号染色体异常约占11%,大部分患者(70-80%)呈染色体正常核型(相比较成人MDS>60%染色体检测异常);
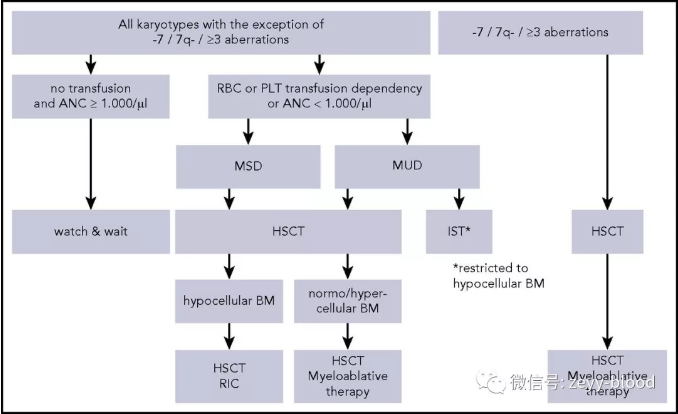
➤症状轻微时可以暂时等待和观察,当疾病进展(中性粒<1000)或者存在7号染色体异常,积极启动造血干细胞移植。
CASE 2
13岁女孩
症状:反复发热15天
实验室检查:
中性粒细胞 12.3 × 109/L(轻度升高), 血红蛋白 7.2 g/dL(中度贫血), 血小板 52 × 109/L,外周血原始细胞2%。
骨髓检查:原始细胞比例18%,红系和巨核系病态造血。没有异常家族史,染色体检测正常。
诊断:MDS(原始细胞增多-II型)
治疗方案:
亲缘中未找到全相合供者,启动非亲缘全相合基因造血干细胞移植。清髓性预处理方案BU/CY,随访至移植后14个月,患者一般情况良好处于持续缓解状态。
分析:
➤骨髓和外周血中原始细胞比例和染色体核型异常与MDS预后密切相关,存在复杂核型预后最差;
➤对于原始细胞增多的MDS患者,单纯化疗的5年生存率<30%, 选择异基因造血干细胞移植可以提升至63%;
➤预处理方案包括白消安、环磷酰胺和马法兰,预处理前是否需要强化疗仍未明确,并不推荐作为常规处理方案,但对于原始细胞比例高的患者可以通过化疗降低移植前肿瘤负荷;
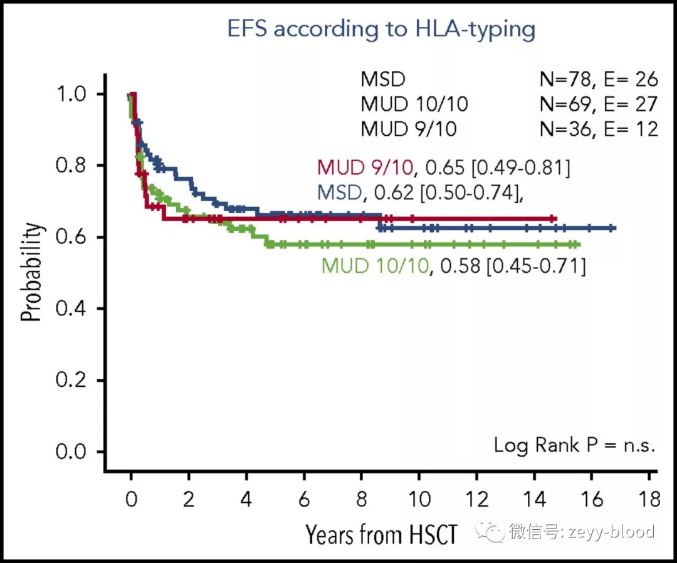
➤干细胞供者是否是亲缘或者非亲缘疗效上没有明显差异。
CASE 3
13岁男孩
症状:长期血常规三系减少
实验室检查:
白细胞 3.3 × 109/L, 血红蛋白 10.4 g/dL, 血小板 92× 109/L
骨髓检查:原始细胞比例3%,染色体显示:+8, 同时存在GATA2基因6外显子错义突变。父母亲都没有检测到类似突变存在。
诊断:儿童难治性血细胞减少(RCC)
由于患儿没有同胞,目前正在寻找合适的非亲缘供者。
分析:
➤非症状性家族性MDS/AML易感综合征涉及基因突变如:GATA2, ETV6, SRP72, SAMD9, SAMD9L;
➤GATA2胚系突变影响造血、免疫、淋巴系统,易发生感染性疾病,同时这些患者有进展为MDS或急性白血病高风险;
➤GATA2突变的儿童更容易合并不良染色体异常(70%存在7号染色体异常),是不良预后指标,因➤GATA2突变是后天形成的,<4岁之前没有检测到此突变发生,同时GATA2突变的MDS患儿年龄相对要大(平均发病年龄12.3岁);
➤主要治疗方案选择异基因造血干细胞移植,同时,如果是同胞供者需要检测是否存在相同基因突变。
CASE 4
5岁女童
明确诊断为伯基特淋巴瘤(IV期,骨髓受累),CD20利妥昔单抗联合化疗(包括环磷酰胺、依托泊苷)6个疗程后达到完全缓解,随后门诊随诊。
随访6个月时患者出现血小板计数下降(63×109 / L),进行性恶化,并出现中性粒细胞减少(0.9×109/L),骨髓检查发现出现复杂核型,涉及11q23。
诊断:治疗相关MDS(转化型MDS, t-MDS)
同胞供者(姐姐)HLA配型相合,进行异基因造血干细胞移植,预处理方案包括马利兰、环磷酰胺和美法仑。
移植后出现III度急性GVHD(皮肤和肝脏),经过光疗和类固醇激素治疗后好转,随访至移植后9月,疾病复发,骨髓原始细胞比例升高至10%,同时再次出现复杂染色体核型,移植后12月,患者因疾病进展而死亡。
分析:
➤转化型MDS/AML(t-MDS/AML)的治疗一直是严峻挑战,5年生存率约~35%(CIBMTR和EBMT数据);
➤与生存相关的因素是诊断到移植的时间,因此推荐尽快进行异基因造血干细胞移植,同时不建议去除供体的T淋巴细胞;
➤疾病复发是主要的死亡原因,因此移植后需密切监测移植物的嵌合状态,一旦发现有复发迹象,临床试验和新的免疫治疗可能是一种选择。
总结
儿童MDS和成人MDS在形态学、细胞遗传学和治疗上存在显著差异,儿童MDS存在易感性因素,存在特定的基因突变。
后续面临治疗决策的挑战,包括造血干细胞移植的适应症和时机的选择、移植前治疗和预处理方案等等。